17、(7分)参考下表中各物质的熔点回答有关问题:
|
物质 |
NaF |
NaCl |
NaBr |
NaI |
NaCl |
KCl |
RbCl |
CsCl |
|
熔点(℃) |
995 |
801 |
755 |
651 |
801 |
776 |
715 |
646 |
|
物质 |
SiF4 |
SiCl4 |
siBr4 |
SiI4 |
SiCl4 |
GeCl4 |
SnCl4 |
PbCl4 |
|
熔点(℃) |
-90.2 |
-70.4 |
-5.2 |
12.5 |
-70.4 |
-49.5 |
-36.2 |
-15.0 |
(1)钠的卤化物及碱金属的氯化物的熔点与 离子键强弱 有关,随着 卤素离子半径增大,键长 增大键能减小,故熔点依次降低。
(2)硅的卤化物的熔点与 分子间作用力强弱 有关,随着 相对分子量 增大 分子间作用力 增大,故熔点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与 晶体类型/微粒间作用力 有关,因为 离子晶体/离子键的强度远大于分子间作用力 ,故前者的熔点远高于后者。
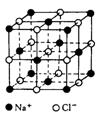 (12分)下面是一种简单可行的测定阿伏加德罗常数的步骤:
(12分)下面是一种简单可行的测定阿伏加德罗常数的步骤: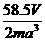 。
。 ,B的结构式为
,B的结构式为 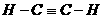 。C的名称是 一氧化碳 。
。C的名称是 一氧化碳 。