28.(16分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应 负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L。设计除去CuCl2溶液中Fe3+和Fe2+,并得到CuCl2·xH2O的实验步骤如下,参照下表给出的数据和药品填空:
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
|
提供的药品:Cl2 浓H2SO4
NaOH溶液 CuO Cu |
①向溶液中 ,将 ;
②加入 调节溶液的pH至 ;
③ (填操作名称),得到CuCl2溶液。
④将滤液 、 、 、自然干燥,得到CuCl2·xH2O。
(4)在测定所得氯化铜晶体(CuCl2·xH2O)中结晶水x值的实验过程中:称量操作至少要进行 次。
(5)若测定结果x值偏高,可能的原因是 .
a. 在加热时有少量晶体从坩埚中溅出 b. 氯化铜晶体的颗粒较大
c. 加热后放在干燥器中冷却 d. 氯化铜晶体部分风化
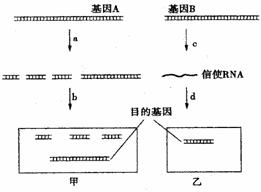
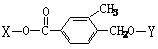
 为推测W的分子结构,进行如图的转化:
为推测W的分子结构,进行如图的转化: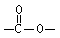 结构的基团
结构的基团
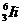 )俘获一个速度为7.7×104m/s的中子后,生成一个氚核和一个氦核,已知氚核的速度大小为1.0×103m/s,方向与中子的运动方向相反。
)俘获一个速度为7.7×104m/s的中子后,生成一个氚核和一个氦核,已知氚核的速度大小为1.0×103m/s,方向与中子的运动方向相反。 =2.014102
=2.014102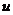 ,氚核质量为
,氚核质量为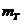 =3.016050
=3.016050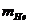 =4.002603
=4.002603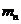 =1.008665
=1.008665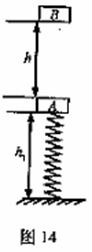 (16分)如图14所示,一轻质弹簧竖直固定在地面上,自然长度l0=0.50m,上面连接一个质量m1=1.0kg的物体A,平衡时物体距地面h1=0.40m,此时弹簧的弹性势能Ep=0.50J。在距物体A正上方高为h=0.45m处有一个质量m2=1.0kg的物体B自由下落后,与弹簧上面的物体A碰撞并立即以相同的速度运动,已知两物体不粘连,且可视为质点,g=10m/s2。求:
(16分)如图14所示,一轻质弹簧竖直固定在地面上,自然长度l0=0.50m,上面连接一个质量m1=1.0kg的物体A,平衡时物体距地面h1=0.40m,此时弹簧的弹性势能Ep=0.50J。在距物体A正上方高为h=0.45m处有一个质量m2=1.0kg的物体B自由下落后,与弹簧上面的物体A碰撞并立即以相同的速度运动,已知两物体不粘连,且可视为质点,g=10m/s2。求: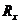 的值.
的值. ;测量通过电阻的电流时,开关S应 ,将多用电表选择开关置于电流档,红表笔接
,黑表笔接 ,记下通过电阻的电流
;测量通过电阻的电流时,开关S应 ,将多用电表选择开关置于电流档,红表笔接
,黑表笔接 ,记下通过电阻的电流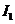 ,调节滑动变阻器触头的位置,重复上述方法再测出两组数据
,调节滑动变阻器触头的位置,重复上述方法再测出两组数据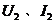 和
和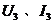 ,利用上述三组数据可求出被测电阻的阻值
,利用上述三组数据可求出被测电阻的阻值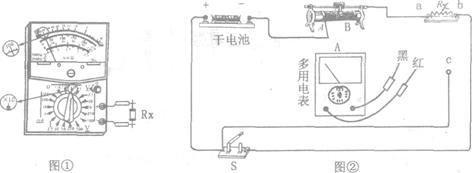
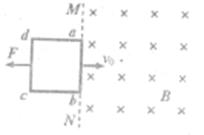 如图所示,在光滑水平面上直线MN右侧有垂直于水平面向下足够大的匀强磁场,一个电阻为R的矩形线框abcd受到水平向左的恒定拉力F作用,以一定的初速度v0向右进入磁场,经过一段时间后又向左离开磁场。在整个运动过程中ab边始终平行于直线MN。则线框向右运动进入磁场和向左运动离开磁场这两个过程中(
)
如图所示,在光滑水平面上直线MN右侧有垂直于水平面向下足够大的匀强磁场,一个电阻为R的矩形线框abcd受到水平向左的恒定拉力F作用,以一定的初速度v0向右进入磁场,经过一段时间后又向左离开磁场。在整个运动过程中ab边始终平行于直线MN。则线框向右运动进入磁场和向左运动离开磁场这两个过程中(
)