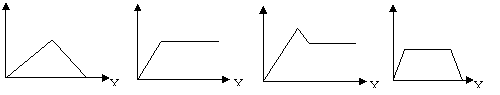
20、在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(X)与溶液中沉淀物的量(Y)的关系示意图中正确的是 ( )
 Y
Y
Y Y
Y
Y
Y Y
0 0 0 0
A B C D
20、在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(X)与溶液中沉淀物的量(Y)的关系示意图中正确的是 ( )
 Y
Y
Y Y
Y
Y
Y Y
0 0 0 0
A B C D