0 18372 18380 18386 18390 18396 18398 18402 18408 18410 18416 18422 18426 18428 18432 18438 18440 18446 18450 18452 18456 18458 18462 18464 18466 18467 18468 18470 18471 18472 18474 18476 18480 18482 18486 18488 18492 18498 18500 18506 18510 18512 18516 18522 18528 18530 18536 18540 18542 18548 18552 18558 18566 447348
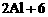 H+ ══2Al3++3H2↑
H+ ══2Al3++3H2↑ 2008-2009学年第一学期期末调研考试
2008-2009学年第一学期期末调研考试