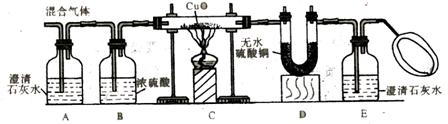
25.某学习小组用图示装置测定黄铜屑(锌铜合金)的组成,取一定量的黄铜屑放入烧杯中,并加入足量稀硫酸。不同时间电子天平的读数如下表所示(不考虑H2O逸出):
|
反应时间/min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
烧杯及所盛物 质总质量/g |
335.70 |
335.54 |
335.44 |
335.38 |
335.34 |
335.32 |
335.31 |
335.30 |
335.30 |
(1) 反应生成H2的总质量为_______________g。
(2) 若要计算黄铜屑中锌质量分数,还缺少的数据是____________,若该数据用a表示,求出黄铜屑中锌的质量分数(写出计算过程)
22.小明同学在学习酸的性质时,他用大小、外形均相同的铝片分别和H+浓度相同的稀盐酸、稀硫酸反应。他意外地发现:铝片与稀盐酸反应放出气泡的速度明显快于与稀硫酸反应放出气泡的速度。是什么原因导致了反应现象的差异呢?小明从微观角度分析得出,H+浓度相同的盐酸、硫酸中,只是所含_____________不同。
小时提出了如下猜想:
①Cl-能促进铝和酸的反应,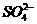 对反应无影响;
对反应无影响;
②Cl-对反应无影响,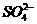 能抑制铝和酸的反应;
能抑制铝和酸的反应;
③Cl-能促进铝和酸的反应,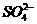 能抑制铝和酸的反应。
能抑制铝和酸的反应。
他进行了如下实验探究:
|
组别 |
相同的铝片 |
H+浓度 相同的酸 |
反应片刻后添加 某种试剂(少量) |
添加试剂后的反应现象 |
结 论 |
|
1 |
1g铝片 |
5mL |
Na2SO4 |
无明显变化 |
_____和_____离子对反应无影响 |
|
2 |
1g铝片 |
5mL |
NaCl |
明显加快 |
_____离子对反应有促进作用 |
针对上述探究过程回答下列问题:
(1)请你将表格中的空格补充完整。
(2)上述猜想____________是成立的。
(3)若将第2组实验中添加的试剂NaCl改为HCl气体,能否完成探究任务?请说明原因。
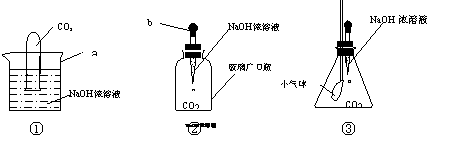 小明在探究CO2和NaOH是否发生反应时,设计出下列三种装置进行实验:
小明在探究CO2和NaOH是否发生反应时,设计出下列三种装置进行实验: