 21、(8’)AB2型离子化合物的阴、阳离子的电子层结构相同,每摩AB2分子中含有54mol电子。已知还有下列反应:
21、(8’)AB2型离子化合物的阴、阳离子的电子层结构相同,每摩AB2分子中含有54mol电子。已知还有下列反应:
①H2+B2 C ②B2+X→Y+AB2+H2O ③Y+C→AB2+Z(Z有漂白作用)
a写出下列物质的化学式:
AB2__________,X____________,Y____________,Z______________。
b用电子式表示化合物,AB2的形成过程:_________________________________
c写出反应②的化学方程式:________________________________________。
|
|
B |
|
|
A |
X |
C |
|
|
D |
|
22、(9’)A、B、C、D4种元素均为主族元素,在周期
表中分别处于元素X的四周,(见右图),已知X元素的
最高价氧化物的化学式为X2O5,且这五种元素中有一种
元素的原子半径是它所处的哪一族中半径最小的。
(1)写出下列各元素的元素符号
A______B______C_______D_______X________
(2)C、D、X的最高价氧化物对应的水化物的酸性由弱到强的顺序为______________________________________________________
(3)A、B、X所形成的3种气态氧化物的稳定性由强到弱的顺序为:
________________________________________________________
(4)在周期表中排放在A前面且与A紧密相邻的元素的氧化物与NaOH溶液反应的离子方程式为:
_____________________________________________________________________________
14、A、B、C、D、E五种元素,从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如下:
|
A |
B |
C |
D |
E |
五种元素不一定位于同一周期,则下列说法中正确的是:
A、E元素的最高化合价为+7时,D元素的负化合价可为-2价
B、A(OH)n为强碱时,B(OH)m也一定为强碱
C、HnDOm为强酸时,E的非金属性一定很强
D、HnCOm为强酸时,E的单质可能为强还原剂

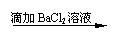 (8分)几位同学设计了下列实验方案以检验SO42-,并都认为,如果观察到的现象和自己设计的方案一致,即可确证试溶液中含有SO42-。请你简要分析说明各方案是否严密。
(8分)几位同学设计了下列实验方案以检验SO42-,并都认为,如果观察到的现象和自己设计的方案一致,即可确证试溶液中含有SO42-。请你简要分析说明各方案是否严密。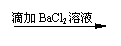
 方案甲: 试液
白色沉淀
未逸出气体,也未见沉淀溶液解
方案甲: 试液
白色沉淀
未逸出气体,也未见沉淀溶液解
 方案乙: 试液
无沉淀 、无气体
白色沉淀
方案乙: 试液
无沉淀 、无气体
白色沉淀 




 高一化学期中试题答案页
高一化学期中试题答案页