摘要:如图所示.弹簧测力计下悬挂一重 物.若向CuSO4溶液中逐渐滴 加Ba(OH)2溶液至恰好完全反应后.弹簧测力 计的示数将 (填“变大 .“变小 或 “不变 ),发生反应的离子方程式是: .
网址:http://m.1010jiajiao.com/timu3_id_159026[举报]
 研究硫及其化合物性质有重要意义.
研究硫及其化合物性质有重要意义.(1)Cu2S在高温条件下发生如下反应:
2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-773kJ?mol-1.
当该反应有0.2mol SO2生成时,反应释放出的热量为
77.3
77.3
kJ.(2)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g).
向2L的容器中充入2mol SO2、1mol O2,SO2的平衡转化率与温度的关系如图所示.
T1温度下,反应进行到状态D时,v(正)
>
>
v(逆)(填“>”“<”或“=”)温度为T1时,反应的平衡常数K=
1620
1620
.若在T3温度时,达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2并使之重新达到平衡,测得又放出热量Q2.则下列说法正确的是
c
c
.(填序号字母)a.容器的压强增大原来的两倍
b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80%
d.T3时的平衡常数大于T1时的平衡常数
(3)为了验证SO2既具有还原性还具有酸性氧化物的性质,下列试剂中能选取的合适实验试剂依次是
d
d
、b
b
(填序号字母).a.品红溶液 b.澄清的石灰水 c.烧碱溶液 d.溴水
(4)实验室存放的Na2SO3溶液容易变质,请完成下列检验该Na2SO3溶液是否变质的实验报告:
①步骤一:用试管取适量的待测溶液;
②步骤二:向所取溶液中
加入用盐酸酸化的BaCl2溶液
加入用盐酸酸化的BaCl2溶液
;③实验现象及对应结论:
若出现白色沉淀,则Na2SO3溶液变质,若不出现白色沉淀,则Na2SO3溶液未变质
若出现白色沉淀,则Na2SO3溶液变质,若不出现白色沉淀,则Na2SO3溶液未变质
.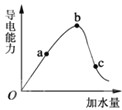 如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答.
如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答.(1)“O”点为什么不导电
因为冰醋酸未电离,无自由移动的离子
因为冰醋酸未电离,无自由移动的离子
.(2)a、b、c三点的氢离子浓度由小到大的顺序为
c<a<b
c<a<b
.(3)a、b、c三点中,醋酸的电离程度最大的一点是
c
c
.(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择
A、C、E、F、G、H
A、C、E、F、G、H
.A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水
E加固体CH3COONa F.加Zn粒 G.加MgO固体 H.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是
B、D
B、D
.A.c(H+) B.H+个数 C.CH3COOH分子数 D.c(H+)/c(CH3COOH)
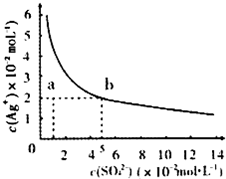 (2013?淄博一模)某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )
(2013?淄博一模)某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )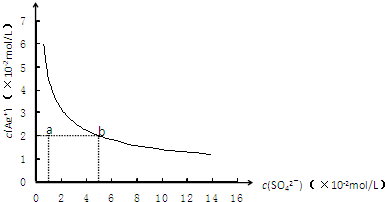
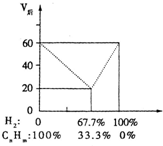 分子式为CnHm的有机物以Ni为催化剂与足量H2反应生成CnHm+x气态有机物.若取不同比例的CnHm和H2的混合物,体积共为60mL,混合气体的比例和反应
分子式为CnHm的有机物以Ni为催化剂与足量H2反应生成CnHm+x气态有机物.若取不同比例的CnHm和H2的混合物,体积共为60mL,混合气体的比例和反应