1.

 (09四川绵阳)
(09四川绵阳)
|

 ①在空气中点燃镁带:2Mg+O2=====2MgO
①在空气中点燃镁带:2Mg+O2=====2MgO

 ②用稀盐酸除铁锈:FeO+2HCl=== FeCl2+H2O。
②用稀盐酸除铁锈:FeO+2HCl=== FeCl2+H2O。

 ③用锌粒和稀盐酸制氢气:Zn +2HC1=====ZnCl2+H2↑
③用锌粒和稀盐酸制氢气:Zn +2HC1=====ZnCl2+H2↑

 ④将主要成分为碳酸钙的贝壳投入稀盐酸:CaCO+HCl===CaCl2+CO2↑+ H2O
④将主要成分为碳酸钙的贝壳投入稀盐酸:CaCO+HCl===CaCl2+CO2↑+ H2O

 A.①②
B.③④ C.①③ D.②④
A.①②
B.③④ C.①③ D.②④

 关键词:化学方程式的应用
关键词:化学方程式的应用

 答案:D
答案:D
4.

 在工业中硫酸铜有不少用途。某工厂用硫化铜(CuS)制硫酸铜(CuSO4),拟选择两个方案。
在工业中硫酸铜有不少用途。某工厂用硫化铜(CuS)制硫酸铜(CuSO4),拟选择两个方案。
|
方案 |
方案① |
方案② |
|
原理 |
CuS是在硫杆菌(催化剂)的作用下与空气中的氧气发生化合反应生成硫酸铜。 |
2CuS+3O2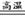 2CuO+2SO2 2CuO+2SO2   CuO+H2SO4==CuSO4+H2O CuO+H2SO4==CuSO4+H2O |
(1)请写出方案①反应的化学方程式___ 。



 (2)在两个方案中①更合理。理由是方案①具有以下优点:优点一:__________,优点二:__________。
(2)在两个方案中①更合理。理由是方案①具有以下优点:优点一:__________,优点二:__________。









 答案 课题2 1.D 解析:先根据反应前后物质的质量改变,确定反应物和生成物。反应后质量减少的是反应物,反应后质量增加的是生成物。故X是反应物,Y、Z是生成物。由于生成物Y和Z的质量和为2+14=16.大于参加反应的X的质量4,故Q也是反应物,且有12gQ参加反应。Y和Q发生改变的质量比为2:12 。再设X的计量数为a,Q的计量数为b,则X和Q的质量比为:a·n:b·2n=4:12,解得;a:b=2:3. 2.D 解析:该题采用代入法。利用相对分子质量的比等于实际质量的比时,化学方程式才正确。3.C 4.(1)CuS+2O2
答案 课题2 1.D 解析:先根据反应前后物质的质量改变,确定反应物和生成物。反应后质量减少的是反应物,反应后质量增加的是生成物。故X是反应物,Y、Z是生成物。由于生成物Y和Z的质量和为2+14=16.大于参加反应的X的质量4,故Q也是反应物,且有12gQ参加反应。Y和Q发生改变的质量比为2:12 。再设X的计量数为a,Q的计量数为b,则X和Q的质量比为:a·n:b·2n=4:12,解得;a:b=2:3. 2.D 解析:该题采用代入法。利用相对分子质量的比等于实际质量的比时,化学方程式才正确。3.C 4.(1)CuS+2O2 CuSO4 (2)不产生有毒气体 不需要加热
CuSO4 (2)不产生有毒气体 不需要加热









1.

 在一个密闭容器内有四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如下:
在一个密闭容器内有四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如下:
|
物质 |
X |
Y |
Z |
Q |
|
反应前质量/g |
4 |
10 |
1 |
21 |
|
反应后质量/g |
0 |
12 |
15 |
待测 |
已知X的相对分子质量为n,Q的相对分子质量为2n。下列推理正确的是( )


 A.参加反应的Q的质量为9g
B.反应后生成15gZ
A.参加反应的Q的质量为9g
B.反应后生成15gZ


 C.反应中Y与Q发生改变的质量之比为1:1 D.该反应中x与Q的化学计量数之比为2:3
C.反应中Y与Q发生改变的质量之比为1:1 D.该反应中x与Q的化学计量数之比为2:3
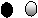 (2007·浙江)下图是用来表示物质间发生化学变化的模型示意图,图中“ 、 ”分别表示两种不同元素的原子。能用该示意图表示的反应是
( )
(2007·浙江)下图是用来表示物质间发生化学变化的模型示意图,图中“ 、 ”分别表示两种不同元素的原子。能用该示意图表示的反应是
( )  2H2O B.2H2O
2H2O B.2H2O  2H2↑+O2↑
2H2↑+O2↑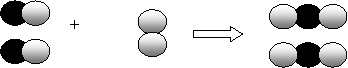 C.2CO+O2
C.2CO+O2 2CO2 D.H2+Cl2
2CO2 D.H2+Cl2

 经过学习我们可以初步认识到:化学反应的快慢、现象、生成物等与反应物量的多少、反应条件有着密切的关系。请各举一例说明:
经过学习我们可以初步认识到:化学反应的快慢、现象、生成物等与反应物量的多少、反应条件有着密切的关系。请各举一例说明: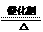 2KCl+3O2
↑
2KCl+3O2
↑  CO2
②2CO+O2
CO2
②2CO+O2