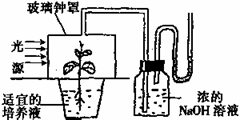
27.(16分)关于研究植物生理的实验。
I.如右图装置。
(1)若取植物叶片检测发现没有淀粉产生。这可以说明光合作用需要 。
(2)为了结论的可靠性,实验前应让植株在黑暗中放置一昼夜。这是为了 。
(3)该实验的对照组是将同样装置内NaOH溶液换成 。
(4)若将玻璃钟罩遮光,并将NaOH溶液换为澄清的石灰水,就可以用来验证 。若将NaOH溶液换为CO2的缓冲溶液,则可用这一装置测定 。
(5)从实验装置图的设置可以看出提高光合作用效率的措施有
(至少两种)。
II.另一个实验。取生理状况相同的叶子分成四等份,在不同温度下分别暗处理1h,再用适当且相同的光照射1h,测其重量变化(注:均与暗处理前相比),结果见下表。
|
组别 |
1 |
2 |
3 |
4 |
|
温度(℃) |
27 |
28 |
29 |
30 |
|
暗处理后的重量变化值/mg |
-1 |
-2 |
-3 |
-1 |
|
光照后的重量变化值/mg |
+3 |
+3 |
+3 |
+1 |
假设相同温度下呼吸作用强度不变,据表分析, ℃下呼吸作用最强,28℃下的实际光合速率是 mg/h。
26.(16分)某兴趣小组的同学对本市四所高中一年级的全体学生进行色盲发病率调查,结果汇总如下表,请根据表中数据分析回答:
|
性状 |
表现型 |
校一 |
校二 |
校三 |
校四 |
||||
|
男 |
女 |
男 |
女 |
男 |
女 |
男 |
女 |
||
|
色觉 |
正常 |
404 |
398 |
524 |
432 |
436 |
328 |
402 |
298 |
|
色盲 |
8 |
0 |
13 |
1 |
6 |
0 |
12 |
0 |
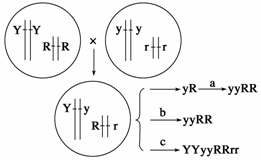
(1)上述表中数据可反映出色盲遗传具有_________________________的特点。假设被调查群体的女性正常个体中有300人为色盲基因携带者。则被调查的人群中色盲基因的频率是_________%(保留一位小数)。 (2)调查自然人群色盲发病率的正确方法是____ __ ________,注意调查群体要 ;调查色盲遗传方式的正确方法是__________ _____ _____。 (3)调查中发现一男生(Ⅲ10)患有色盲,其同胞姐姐患有白化病,经调查其家庭系谱图如下:
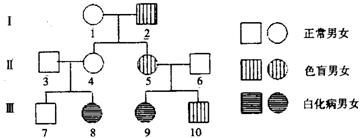
Ⅲ8的白化病基因直接来自 ;若Ⅲ10与Ⅲ8婚配,子女两病兼患的概率是__________。当地人群中约200个表现型正常的人中有一个携带者。一个双亲表现型正常,其弟弟是白化病患者的正常女人,与当地一个无亲缘关系的正常男人婚配,他们所生孩子患白化病的概率为_____________。
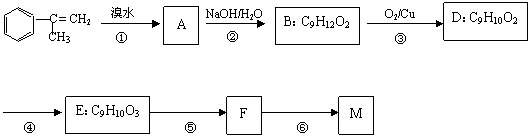
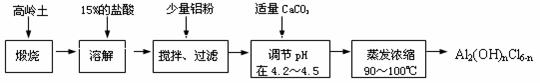 制备碱式氯化铝的实验流程如下:
制备碱式氯化铝的实验流程如下: II 2HI H2+I2
II 2HI H2+I2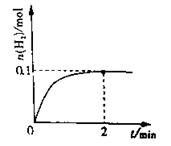
 (2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=
。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=
。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。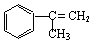
 www.k@s@5@
高#考#资#源#网
www.k@s@5@
高#考#资#源#网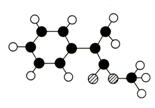


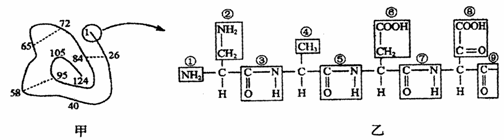 的部分放大图(图乙),正确的是
的部分放大图(图乙),正确的是