0 124037 124045 124051 124055 124061 124063 124067 124073 124075 124081 124087 124091 124093 124097 124103 124105 124111 124115 124117 124121 124123 124127 124129 124131 124132 124133 124135 124136 124137 124139 124141 124145 124147 124151 124153 124157 124163 124165 124171 124175 124177 124181 124187 124193 124195 124201 124205 124207 124213 124217 124223 124231 447348
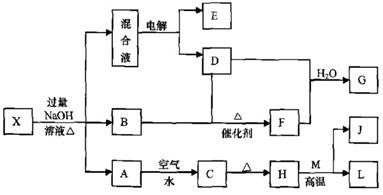
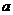
 E气体在D中完全燃烧生成稳定的化合物时,放出
E气体在D中完全燃烧生成稳定的化合物时,放出 kJ的热量,写出E燃烧热的热化学方程式
。
kJ的热量,写出E燃烧热的热化学方程式
。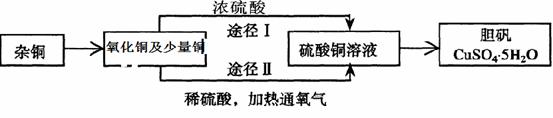
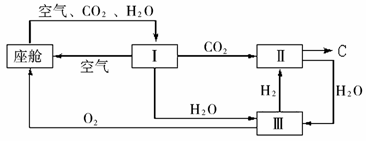 (1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式为
。
(1)Ⅱ是CO2和H2的反应装置,该反应的化学方程式为
。
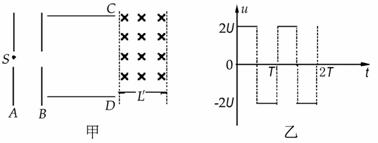 (21分)如图甲所示,A、B两板间距为
(21分)如图甲所示,A、B两板间距为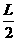 ,板间电势差为U,C、D两板间距离和板长均为L,两板间加一如图乙所示的电压.在S处有一个初速度为0,电荷量为q、质量为m的带电粒子,经A、B间电场加速,又恰好经C、D间还没有变化的电场偏转后,进入一个垂直纸面向里的匀强磁场区域,磁感强度为B.不计重力影响,欲使该带电粒子经过某路径后能返回S处.且自该带电粒子从S处进入到返回S处所需要的时间恰好与C、D间电场变化的周期相同。求:
,板间电势差为U,C、D两板间距离和板长均为L,两板间加一如图乙所示的电压.在S处有一个初速度为0,电荷量为q、质量为m的带电粒子,经A、B间电场加速,又恰好经C、D间还没有变化的电场偏转后,进入一个垂直纸面向里的匀强磁场区域,磁感强度为B.不计重力影响,欲使该带电粒子经过某路径后能返回S处.且自该带电粒子从S处进入到返回S处所需要的时间恰好与C、D间电场变化的周期相同。求: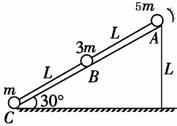
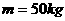 ,在某次训练过程中两人均为逆时针滑行,甲经短距离加速后能保持
,在某次训练过程中两人均为逆时针滑行,甲经短距离加速后能保持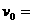 12m/s的速度大小滑完全程;当甲运动到A点时,乙在B点开始滑动,乙从起滑后到交接前的运动可看作匀加速直线运动,其大小为a=3.2
12m/s的速度大小滑完全程;当甲运动到A点时,乙在B点开始滑动,乙从起滑后到交接前的运动可看作匀加速直线运动,其大小为a=3.2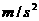 ,甲乙两人在C点完成交接。交接前乙的速度是甲的
,甲乙两人在C点完成交接。交接前乙的速度是甲的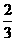 ,交接后甲的速度为原来的
,交接后甲的速度为原来的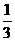 ,速度方向不变。求:
,速度方向不变。求: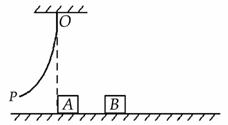 某同学设计了一个验证动量守恒定律的实验,实验装置如图所示,0P为一弹性钢片,A、B为完全相同的物块,质量均为m,水平面的动摩擦因数为μ,实验步骤如下:①先在O点正下方的水平面上只放物块A,把弹性钢片的P端弯曲至Q点(Q点未画出),突然释放钢片,弹性钢片打在物体A上,物体A在水平面上运动x的位移后静止下来;②把物体A放回原处,同时在A的右侧x1处(
某同学设计了一个验证动量守恒定律的实验,实验装置如图所示,0P为一弹性钢片,A、B为完全相同的物块,质量均为m,水平面的动摩擦因数为μ,实验步骤如下:①先在O点正下方的水平面上只放物块A,把弹性钢片的P端弯曲至Q点(Q点未画出),突然释放钢片,弹性钢片打在物体A上,物体A在水平面上运动x的位移后静止下来;②把物体A放回原处,同时在A的右侧x1处(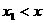 )放置物体B,再次把弹性钢片的P端弯曲至Q点,并突然释放,弹性钢片打在物体A上后,物块A在运动中与B发生碰撞,并粘合成一体继续向前运动
)放置物体B,再次把弹性钢片的P端弯曲至Q点,并突然释放,弹性钢片打在物体A上后,物块A在运动中与B发生碰撞,并粘合成一体继续向前运动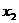 后静止下来。
后静止下来。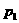 =
;
=
;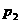 =
。
=
。 经分析
经分析 、
、 、
、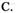 50 V
D.250V
50 V
D.250V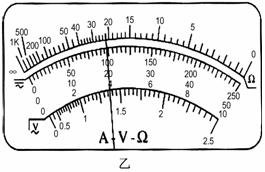
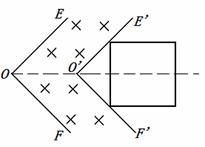 如图所示,EO∥E’O’,FO∥F’O’,且EO⊥OF,OO’为∠EOF的角平分线,OO’间的距离为
如图所示,EO∥E’O’,FO∥F’O’,且EO⊥OF,OO’为∠EOF的角平分线,OO’间的距离为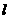 ,折线EOF与E’O’F’之间有一垂直纸面里的匀强磁场。一边长为
,折线EOF与E’O’F’之间有一垂直纸面里的匀强磁场。一边长为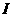 -t)关系的是(时间以
-t)关系的是(时间以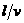 为单位)
为单位)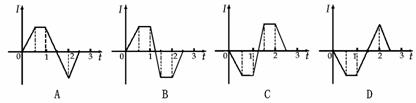
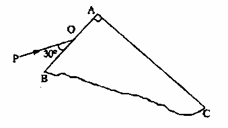 色光PO以与BA成30°角的方向入射在AB侧面上的O点,要使此束光线经AB和AC两界面折射后最终能从AC面射出,棱镜介质对该单色光的折射率应当小于
A.
色光PO以与BA成30°角的方向入射在AB侧面上的O点,要使此束光线经AB和AC两界面折射后最终能从AC面射出,棱镜介质对该单色光的折射率应当小于
A.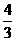 B.
B.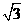 C.
C.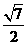 D.1.5
D.1.5