34. 我们做过《探究弹簧弹力与弹簧伸长长度的关系》实验,知道在弹性限度内,弹簧弹力F的大小与弹簧的伸长(或缩短)量x成正比,并且不同的弹簧,其劲度系数不同。现有劲度系数分别为K1、K2的弹簧A和B,若将他们串联成一根新弹簧C,探究弹簧C的劲度系数K与K1、K2的关系。
我们做过《探究弹簧弹力与弹簧伸长长度的关系》实验,知道在弹性限度内,弹簧弹力F的大小与弹簧的伸长(或缩短)量x成正比,并且不同的弹簧,其劲度系数不同。现有劲度系数分别为K1、K2的弹簧A和B,若将他们串联成一根新弹簧C,探究弹簧C的劲度系数K与K1、K2的关系。
(1)同学甲的猜想是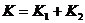 ,同学乙认为
,同学乙认为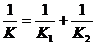 。其中有一位同学的看法是对的,请判断出谁对谁错,并写出你判断的依据。
。其中有一位同学的看法是对的,请判断出谁对谁错,并写出你判断的依据。
(2)为了验证理论推导的正确性,可通过实验来完成。实验所需的器材除弹簧A和B,已知质量且质量相等的钩码外,还需要的器材有 。
(3)研究弹簧C的劲度系数,实验中需要一个数据记录表,请你填写出记录表的测量物理量的名称:
实验数据记录表
弹簧C原长:L0= cm
 测量物理量 测量物理量 数据 数据实验次数 |
|
|
|
弹簧的伸长量x |
弹簧的劲度系数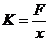 (N/cm) |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
(4)请写出完成实验的步骤。
解答:(1)同学乙的看法是对的。
假设A、B串联成新弹簧C
设C的劲度系数为K,当C两端拉力为F时,C的伸长量
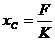 ①
①
又C中A和B的伸长量分别是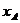 、
、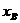

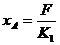 ②
②
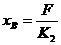 ③
③
A、B串联 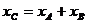 ④
④
①②③代入④有
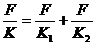 即
即 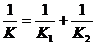
(2)铁架台、刻度尺。
(3)钩码质量M =nm(kg)、弹簧C受到的拉力F=Mg(N)、弹簧的长度L(cm)
(4)实验步骤:
①将A、B串联组成新弹簧C,将C悬挂在铁架台上,用刻度尺测量弹簧C的长度L0;
②在弹簧C的下端挂上已知质量的钩码,记录钩码质量M并用刻度尺测出弹簧的长度L;
③由F=Mg计算弹簧的弹力,由x=L-L0计算弹簧伸长量,由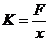 计算弹簧C的劲度系数K;
计算弹簧C的劲度系数K;
④改变悬挂钩码质量,重复实验步骤②、③三次;
⑤取K的平均值,计算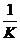 ,比较
,比较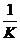 与
与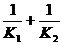 的大小,得出结论。
的大小,得出结论。
(中等难度)
32.已知苯甲醛在一定条件下可以通过Perkin反应生成肉桂酸(产率45 ~ 50 %),另一产物A也呈酸性,反应方程式如下:
|
 C6H5CHO + (CH3CO)2O
C6H5CH=CHCOOH +
C6H5CHO + (CH3CO)2O
C6H5CH=CHCOOH +
苯甲醛 肉桂酸
(1)Perkin反应合成肉桂酸的反应式中,反应物的物质的量之比为1﹕1,产物A的名称是 。
(2)一定条件下,肉桂酸与乙醇反应生成香料肉桂酸乙酯,其反应方程式为
(不要求标出反应条件)。
(3)溴苯(C6H5Br)与丙烯酸乙酯(CH2=CHCOOC2H5)在氯化钯催化下可直接合成肉桂酸乙酯(该反应属于Heck反应,是芳香环上的一种取代反应),其反应方程式为
(不要求标出反应条件)。
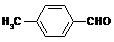
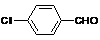
 (4)取代苯甲醛也能发生Perkin反应,相应产物的产率如下:
(4)取代苯甲醛也能发生Perkin反应,相应产物的产率如下:
|
取代苯甲醛 |
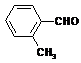 |
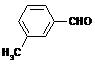 |
 |
 |
|
产率(%) |
15 |
23 |
33 |
0 |
|
取代苯甲醛 |
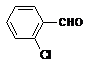 |
 |
 |
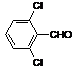 |
|
产率(%) |
71 |
63 |
52 |
82 |
可见,取代基对Perkin反应的影响有(写出3条即可):
① ;
② ;
③ 。
答案:
(1)乙酸
(2)C6H5CH=CHCOOH + C2H5OH -→ C6H5CH=CHCOOC2H5 + H2O
(3) C6H5Br + CH2=CHCOOC2H5 -→ C6H5CH=CHCOOC2H5 + HBr
(4)①苯环上有氯原子取代对反应有利;
②苯环上有甲基取代对反应不利;
③氯原子的位置与CHO越远,对反应越不利(或回答:氯原子取代时,邻位最有利,对位最不利);
④甲基的位置与CHO越远,对反应越有利(或回答:甲基取代时,邻位最不利,对位最有利);
⑤苯环上氯原子越多,对反应越有利;
⑥苯环上甲基越多,对反应越不利。
(中等难度)
30.甲酸甲酯水解反应方程式为:
HCOOCH3(l)
+ H2O(l)  HCOOH(l) + CH3OH(l) △H > 0
HCOOH(l) + CH3OH(l) △H > 0
 某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
|
组分 |
HCOOCH3 |
H2O |
HCOOH |
CH3OH |
|
物质的量 / mol |
1.00 |
1.99 |
0.01 |
0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化见图14:
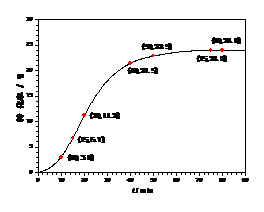
图14
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
|
反应时间范围 /min |
0~5 |
10~15 |
20~25 |
30~35 |
40~45 |
50~55 |
75~80 |
|
平均反应速率 / ( 10-3 mol×min-1 ) |
1.9 |
7.4 |
7.8 |
4.4 |
1.6 |
0.8 |
0.0 |
请计算15~20 min范围内甲酸甲酯的减少量为 mol,甲酸甲酯的平均反应速率为 mol×min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因: 。
(3)上述反应的平衡常数表达式为: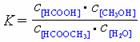 ,则该反应在温度T1下的K值为
。
,则该反应在温度T1下的K值为
。
(4)其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
答案:
(1)0.045 9.0×10-3
(2)该反应中甲酸具有催化作用。
 ①反应初期:虽然甲酸甲酯量较大,但甲酸量很小,催化效果不明显,反应速率较慢;
①反应初期:虽然甲酸甲酯量较大,但甲酸量很小,催化效果不明显,反应速率较慢;
②反应中期:甲酸量逐渐增多,催化效果显著,反应速率明显增大;
③反应后期:甲酸量增加到一定程度后,浓度对反应速率的影响成主导因素,特别是逆反应速率的增大,使总反应速率逐渐减小,直至为零。
(3)0.14 (4)如图15

图15
(中等难度)
29.三草酸合铁酸钾晶体K3[Fe(C2O4)3]×3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1 HNO3、1.0 mol·L-1 盐酸、1.0 mol·L-1 NaOH、3% H2O2、0.1 mol·L-1 KI、0.1 mol·L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是 ,现象是 。
 (3)固体产物中铁元素存在形式的探究。
(3)固体产物中铁元素存在形式的探究。
① 提出合理假设
假设1: ;假设2: ;假设3: 。
② 设计实验方案证明你的假设(不要在答题卡上作答)
③ 实验过程
根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
|
实验步骤 |
预期现象与结论 |
|
步骤1: |
|
|
步骤2: |
|
|
步骤3: |
|
|
…… |
|
答案:
(1)CO和CO2 (2)利用焰色反应 透过蓝色钴玻璃观察到紫色火焰
(3)①全部为铁单质 全部为FeO 同时存在铁单质和FeO
③
|
实验步骤 |
预期现象与结论 |
|
步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使K2CO3完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。 |
固体部分溶解。 |
|
步骤2:向试管中加入适量CuSO4溶液,再加入少量上述不溶固体,充分振荡。 |
(1)若蓝色溶液颜色及加入的不溶固体无明显变化,则假设2成立。 (2)若蓝色溶液颜色明显改变,且有暗红色固体物质生成,则证明有铁单质存在。 |
|
步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN。 |
结合步骤2中的(2): (1)若溶液基本无色,则假设1成立。 (2)若溶液呈血红色,则假设3成立。 |
(中等难度)
 ,其性质类似于苯)的化合物Ⅱ作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
,其性质类似于苯)的化合物Ⅱ作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):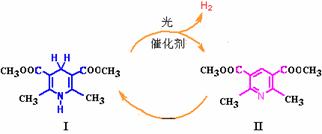
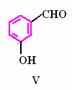
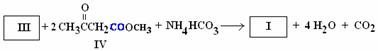
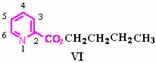 D. 化合物Ⅴ遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应
D. 化合物Ⅴ遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应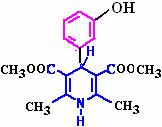
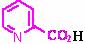 12(中等难度)
12(中等难度)

 (5)酸性物质使沉淀溶解平衡Ca5(PO4)3OH(s) 5Ca2+(aq) + 3PO43-(aq) + OH-(aq) 向右移动,导致Ca5(PO4)3OH溶解,产生龋齿
(5)酸性物质使沉淀溶解平衡Ca5(PO4)3OH(s) 5Ca2+(aq) + 3PO43-(aq) + OH-(aq) 向右移动,导致Ca5(PO4)3OH溶解,产生龋齿
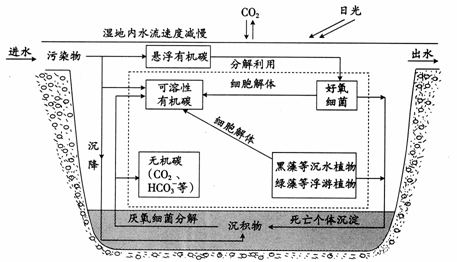
 答案:(1)
答案:(1)