摘要:研究性学习小组为证明甲烷充分燃烧的产物是二氧化碳和水.分别设计了A.B两种实验方案.如下图所示: (1)装置中干燥管内产生的现象是 ,试剂瓶中产生的现象是 , (2)你认为上述 方案更合理.理由是 .
网址:http://m.1010jiajiao.com/timu3_id_97953[举报]
氢氧化钠固体常因吸收空气中的二氧化碳而变质.某研究性学习小组为探究氢氧化钠固体样品中的碳酸钠的质量分数(仅考虑样品为NaOH和Na2CO3的混合物),设计了多种实验方案,请结合以下方案回答有关问题:
方案一:
称取一定量的氢氧化钠样品,加水溶解后,逐滴加入沉淀剂氢氧化钡溶液至不再产生沉淀为止.将沉淀过滤、洗涤、烘干、称量.
则:(1)沉淀洗涤的目的是 ,若不洗涤,则所测定的样品中碳酸钠的质量分数 (填“偏大”、“偏小”或“无影响”).证明沉淀已经洗涤干净的方法:向最后一次洗涤后的滤液中加入 试剂(填化学式),若无沉淀产生,说明洗涤干净.
方案二:
(2)利用下图装置测定氢氧化钠样品中 Na2CO3的质量分数,则必需的数据有:样品质量、反应前 锥形瓶及其中各物质的总质量、 .该方案有误差,请写出引起误差的一个原因: .
锥形瓶及其中各物质的总质量、 .该方案有误差,请写出引起误差的一个原因: .
方案三:
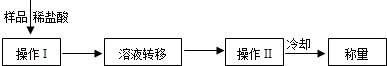
(3)操作Ⅰ中加入稀盐酸应过量的原因是 ,
操作Ⅱ中需要的仪器有铁架台(含铁圈)、玻璃棒、酒精灯和 ,若该方案中样品质量为9.3g,最终称量冷却后的晶体质量为11.7g.
为计算碳酸钠的质量分数,小刚同学通过列二元一次方程组的办法得到两个表达式:
解:设样品中NaOH的质量为x,Na2CO3的质量为y.
请判断这两个方程组中是否存在问题,若有错误,请将纠正后的方程写在横线上: .
经计算碳酸钠的质量分数为 .(写出计算过程)
查看习题详情和答案>>
方案一:
称取一定量的氢氧化钠样品,加水溶解后,逐滴加入沉淀剂氢氧化钡溶液至不再产生沉淀为止.将沉淀过滤、洗涤、烘干、称量.
则:(1)沉淀洗涤的目的是
方案二:
(2)利用下图装置测定氢氧化钠样品中 Na2CO3的质量分数,则必需的数据有:样品质量、反应前
 锥形瓶及其中各物质的总质量、
锥形瓶及其中各物质的总质量、方案三:

(3)操作Ⅰ中加入稀盐酸应过量的原因是
操作Ⅱ中需要的仪器有铁架台(含铁圈)、玻璃棒、酒精灯和
为计算碳酸钠的质量分数,小刚同学通过列二元一次方程组的办法得到两个表达式:
解:设样品中NaOH的质量为x,Na2CO3的质量为y.
|
请判断这两个方程组中是否存在问题,若有错误,请将纠正后的方程写在横线上:
经计算碳酸钠的质量分数为
37、某研究性学习小组欲证明氧化铜也能作为氯酸钾分解反应的催化剂,他们进行了如下实验:

①称取1.0gCuSO4粉末加入10 mL蒸馏水完全溶解;
②将足量的NaOH溶液与上述溶液充分反应,生成蓝色沉淀,过滤后洗涤沉淀;
③将所得沉淀转移到坩埚(一种可用于加热固体物质的容器)中,均匀缓慢加热至完全变为黑色的氧化铜,研细备用;
④按下表中的质量将固体混合好后,在相同条件下加热,并与MnO2的催化效果做比较,实验时间均以生成50 mL气体为准(见图甲),其他可能影响实验的因素均忽略.
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是
(2)写出步骤③的化学方程式
(3)表格中的“待测数据”是指
(4)若实验过程中50mL量气管中液面的位置如图乙所示,A与B刻度间相差1 mL,刻度A的读数为20,则此时量气管中收集到的气体体积为
(5)如果要进一步探究CuO在反应中是否起到催化作用,请完成后续实验.
查看习题详情和答案>>

①称取1.0gCuSO4粉末加入10 mL蒸馏水完全溶解;
②将足量的NaOH溶液与上述溶液充分反应,生成蓝色沉淀,过滤后洗涤沉淀;
③将所得沉淀转移到坩埚(一种可用于加热固体物质的容器)中,均匀缓慢加热至完全变为黑色的氧化铜,研细备用;
④按下表中的质量将固体混合好后,在相同条件下加热,并与MnO2的催化效果做比较,实验时间均以生成50 mL气体为准(见图甲),其他可能影响实验的因素均忽略.
| 编号 | KClO3质量(g) | 其他物质质量(g) | 待测数据 |
| 1 | 2.0 | 不加任何物质 | … |
| 2 | 2.0 | CuO 0.5 | … |
| 3 | 2.0 | MnO2 0.5 | … |
(1)上述实验步骤中需要使用玻璃棒的是
①②③
(填序号).(2)写出步骤③的化学方程式
Cu(OH)2?CuO+H2O
.(3)表格中的“待测数据”是指
生成50mL气体所用的时间
.(4)若实验过程中50mL量气管中液面的位置如图乙所示,A与B刻度间相差1 mL,刻度A的读数为20,则此时量气管中收集到的气体体积为
20.80ml
.(5)如果要进一步探究CuO在反应中是否起到催化作用,请完成后续实验.
| 实验步骤 | 实验过程及现象 | 设计目的 |
| 1 | 加入CuO后产生O2的速率比未加入时快得多 | CuO能加快KClO3的分解 |
| 2 | CuO的质量在反应前后是否保持不变 | |
| 3 |
某研究性学习小组欲证明氧化铜也能作为氯酸钾分解反应的催化剂,他们进行了如下实验:按表中的质量将固体混合好后,在相同条件下加热,并与MnO2的催化效果做比较,实验时间均以生成50 mL气体为准,其他可能影响实验的因素均忽略.
(1)表格中的“待测数据”是指:
(2)后续在老师的指导下共同完成了对氧化铜催化剂的探究实验,确定了它可以做催化剂,由此说明它在反应前后
(3)要探究做过催化剂的CuO其它化学性质,还应补做的实验是
查看习题详情和答案>>
(1)表格中的“待测数据”是指:
生成50mL气体所用的时间
生成50mL气体所用的时间
| 编号 | 氯酸钾的质量 | 其他物质质量 | 待测数据 |
| 1 | 2.0克 | 不加任何物质 | … |
| 2 | 2.0克 | 氧化铜0.5克 | … |
| 3 | 2.0克 | 二氧化锰 0.5克 | … |
质量和化学性质
质量和化学性质
不变,但二氧化锰催化效果会更好点,由此待测数据之间的对比关系为编号1>编号2>编号3
编号1>编号2>编号3
.(3)要探究做过催化剂的CuO其它化学性质,还应补做的实验是
用氢气(或一氧化碳或炭)还原固体,观察固体是否变成红色;或用加热的稀硫酸溶解固体,观察是否能生成蓝色溶液(合理均可)
用氢气(或一氧化碳或炭)还原固体,观察固体是否变成红色;或用加热的稀硫酸溶解固体,观察是否能生成蓝色溶液(合理均可)
.
研究性学习小组为检测实验室用CO还原CuO所得固体中是否含有未反应的CuO,进行了认真的探究.
[方案一]取少量固体样品于试管中,加入适量的稀硫酸,充分振荡后若观察到溶液变成蓝色,则固体样品中含有CuO.请写出有关反应的化学方程式 .
[方案二]设计如图所示的装置进行实验.若装置B中澄清的石灰水变浑浊,证明有CO2生成,则固体样品中含有CuO.有同学认为若将装置B中澄清的石灰水改为NaOH溶液,再通过实验验证B中产物,也可以证明有CO2生成.请你设计并完成验证B中产物的实验:
[方案三]查阅资料:CuO+H2
Cu+H2O;CuSO4(白色)+5H2O=CuSO4?5H2O(蓝色)按如图所示装置进行实验.
(1)若固体样品中含有CuO,则可观察到的实验现象是 .
(2)为确保探究的科学、合理、安全,实验中还应采取的措施有 (填序号).
①加热前先排尽装置中的空气
②在H2发生器与硬质玻璃管A之间加一个干燥装置
③在盛有CuSO4的干燥管B后再连接一个装有碱石灰(主要成分为NaOH和CaO)的干燥管. 查看习题详情和答案>>
[方案一]取少量固体样品于试管中,加入适量的稀硫酸,充分振荡后若观察到溶液变成蓝色,则固体样品中含有CuO.请写出有关反应的化学方程式
[方案二]设计如图所示的装置进行实验.若装置B中澄清的石灰水变浑浊,证明有CO2生成,则固体样品中含有CuO.有同学认为若将装置B中澄清的石灰水改为NaOH溶液,再通过实验验证B中产物,也可以证明有CO2生成.请你设计并完成验证B中产物的实验:

| 实验步骤 | 实验现象 | 反应的化学方程式 |
| (1)______ | (2)_______ | (3)______ |
| ||
(1)若固体样品中含有CuO,则可观察到的实验现象是

(2)为确保探究的科学、合理、安全,实验中还应采取的措施有
①加热前先排尽装置中的空气
②在H2发生器与硬质玻璃管A之间加一个干燥装置
③在盛有CuSO4的干燥管B后再连接一个装有碱石灰(主要成分为NaOH和CaO)的干燥管. 查看习题详情和答案>>
19、某研究性学习小组为探究镁与水的反应,设计如下实验:
步骤1:将镁条用砂纸打磨至光亮,分成两等份.
步骤2:将一份光亮的镁条置于冷水中,几乎没有观察到任何现象.
步骤3:将另一份光亮的镁条置于热水中,观察到有均匀的气泡产生.
(1)将镁条用砂纸打磨至光亮的目的是
(2)步骤2中没有观察到任何现象,不能说明镁条与冷水不反应,请举出学习过的一个实例说明:
经查阅资料:活泼金属与水反应生成对应的碱和氢气,如果金属活动性越强,生成的碱就越强.某同学就向步骤2的烧杯中滴加酚酞试液,观察到镁条的表面有明显的红色出现,但是红色较淡.该反应的化学方程式为
(3)步骤2和3对比可知,影响镁与水的反应速率的一个条件是
为检验生成的气体是氢气,可以采用的方法
查看习题详情和答案>>
步骤1:将镁条用砂纸打磨至光亮,分成两等份.
步骤2:将一份光亮的镁条置于冷水中,几乎没有观察到任何现象.
步骤3:将另一份光亮的镁条置于热水中,观察到有均匀的气泡产生.
(1)将镁条用砂纸打磨至光亮的目的是
除去表面的氧化膜.
.(2)步骤2中没有观察到任何现象,不能说明镁条与冷水不反应,请举出学习过的一个实例说明:
氢氧化钠与稀盐酸反应无明显现象
.经查阅资料:活泼金属与水反应生成对应的碱和氢气,如果金属活动性越强,生成的碱就越强.某同学就向步骤2的烧杯中滴加酚酞试液,观察到镁条的表面有明显的红色出现,但是红色较淡.该反应的化学方程式为
Mg+2H2O═Mg(OH)2+H2↑.
,由于Mg(OH)2难溶于水,因此形成的溶液碱性较弱.(3)步骤2和3对比可知,影响镁与水的反应速率的一个条件是
温度
,为检验生成的气体是氢气,可以采用的方法
点燃后产物只有水
证明该气体是氢气.
.