题目内容
某研究性学习小组欲证明氧化铜也能作为氯酸钾分解反应的催化剂,他们进行了如下实验:按表中的质量将固体混合好后,在相同条件下加热,并与MnO2的催化效果做比较,实验时间均以生成50 mL气体为准,其他可能影响实验的因素均忽略.
(1)表格中的“待测数据”是指:
(2)后续在老师的指导下共同完成了对氧化铜催化剂的探究实验,确定了它可以做催化剂,由此说明它在反应前后
(3)要探究做过催化剂的CuO其它化学性质,还应补做的实验是
(1)表格中的“待测数据”是指:
生成50mL气体所用的时间
生成50mL气体所用的时间
| 编号 | 氯酸钾的质量 | 其他物质质量 | 待测数据 |
| 1 | 2.0克 | 不加任何物质 | … |
| 2 | 2.0克 | 氧化铜0.5克 | … |
| 3 | 2.0克 | 二氧化锰 0.5克 | … |
质量和化学性质
质量和化学性质
不变,但二氧化锰催化效果会更好点,由此待测数据之间的对比关系为编号1>编号2>编号3
编号1>编号2>编号3
.(3)要探究做过催化剂的CuO其它化学性质,还应补做的实验是
用氢气(或一氧化碳或炭)还原固体,观察固体是否变成红色;或用加热的稀硫酸溶解固体,观察是否能生成蓝色溶液(合理均可)
用氢气(或一氧化碳或炭)还原固体,观察固体是否变成红色;或用加热的稀硫酸溶解固体,观察是否能生成蓝色溶液(合理均可)
.分析:(1)根据该实验是要证明氧化铜也能作为氯酸钾分解反应的催化剂,并与MnO2的催化效果做比较,所以表中“待测数据”是指:生成50mL气体所用的时间;
(2)根据催化剂的特点并结合实验分析回答;
(3)根据氧化铜的化学性质设计实验.
(2)根据催化剂的特点并结合实验分析回答;
(3)根据氧化铜的化学性质设计实验.
解答:解:(1)该实验是要证明氧化铜也能作为氯酸钾分解反应的催化剂,并与MnO2的催化效果做比较,且实验时间均以生成50 mL气体为准,所以表中“待测数据”是指:生成50mL气体所用的时间;
故答案为:生成50mL气体所用的时间;
(2)催化剂能改变其他物质的化学反应速率,而本身的质量和质量和化学性质在反应前后保持不变;根据题意:氧化铜也可作为催化剂,但二氧化锰催化效果会更好点,所以不加任何物质的反应速率最慢,用时最多,加入氧化铜的比加入二氧化锰的用时长;
故答案为:质量和化学性质; 编号1>编号2>编号3;
(3)氧化铜还可与还原剂反应,与酸发生反应;
故答案为:用氢气(或一氧化碳或炭)还原固体,观察固体是否变成红色;或用加热的稀硫酸溶解固体,观察是否能生成蓝色溶液(合理均可).
故答案为:生成50mL气体所用的时间;
(2)催化剂能改变其他物质的化学反应速率,而本身的质量和质量和化学性质在反应前后保持不变;根据题意:氧化铜也可作为催化剂,但二氧化锰催化效果会更好点,所以不加任何物质的反应速率最慢,用时最多,加入氧化铜的比加入二氧化锰的用时长;
故答案为:质量和化学性质; 编号1>编号2>编号3;
(3)氧化铜还可与还原剂反应,与酸发生反应;
故答案为:用氢气(或一氧化碳或炭)还原固体,观察固体是否变成红色;或用加热的稀硫酸溶解固体,观察是否能生成蓝色溶液(合理均可).
点评:本题以实验探究的形式考查了学生对催化剂的理解和对氧化铜性质的掌握,并考查了学生应用知识分析、解决问题的能力.

练习册系列答案
相关题目
某研究性学习小组欲证明氧化铜也能作为氯酸钾分解反应的催化剂,他们进行了如下实验:按表中的质量将固体混合好后,在相同条件下加热,并与MnO2的催化效果做比较,实验时间均以生成50 mL气体为准,其他可能影响实验的因素均忽略.
(1)表格中的“待测数据”是指:______
| 编号 | 氯酸钾的质量 | 其他物质质量 | 待测数据 |
| 1 | 2.0克 | 不加任何物质 | … |
| 2 | 2.0克 | 氧化铜0.5克 | … |
| 3 | 2.0克 | 二氧化锰 0.5克 | … |
(3)要探究做过催化剂的CuO其它化学性质,还应补做的实验是______.
某研究性学习小组欲证明氧化铜也能作为氯酸钾分解反应的催化剂,他们进行了如下实验:
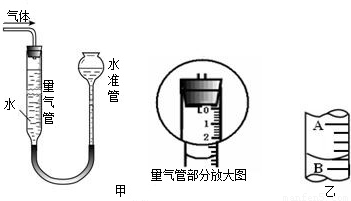
①称取1.0gCuSO4粉末加入10 mL蒸馏水完全溶解;
②将足量的NaOH溶液与上述溶液充分反应,生成蓝色沉淀,过滤后洗涤沉淀;
③将所得沉淀转移到坩埚(一种可用于加热固体物质的容器)中,均匀缓慢加热至完全变为黑色的氧化铜,研细备用;
④按下表中的质量将固体混合好后,在相同条件下加热,并与MnO2的催化效果做比较,实验时间均以生成50 mL气体为准(见图甲),其他可能影响实验的因素均忽略.
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是______(填序号).
(2)写出步骤③的化学方程式______.
(3)表格中的“待测数据”是指______.
(4)若实验过程中50mL量气管中液面的位置如图乙所示,A与B刻度间相差1 mL,刻度A的读数为20,则此时量气管中收集到的气体体积为______.
(5)如果要进一步探究CuO在反应中是否起到催化作用,请完成后续实验.

①称取1.0gCuSO4粉末加入10 mL蒸馏水完全溶解;
②将足量的NaOH溶液与上述溶液充分反应,生成蓝色沉淀,过滤后洗涤沉淀;
③将所得沉淀转移到坩埚(一种可用于加热固体物质的容器)中,均匀缓慢加热至完全变为黑色的氧化铜,研细备用;
④按下表中的质量将固体混合好后,在相同条件下加热,并与MnO2的催化效果做比较,实验时间均以生成50 mL气体为准(见图甲),其他可能影响实验的因素均忽略.
| 编号 | KClO3质量(g) | 其他物质质量(g) | 待测数据 |
| 1 | 2.0 | 不加任何物质 | … |
| 2 | 2.0 | CuO 0.5 | … |
| 3 | 2.0 | MnO2 0.5 | … |
(1)上述实验步骤中需要使用玻璃棒的是______(填序号).
(2)写出步骤③的化学方程式______.
(3)表格中的“待测数据”是指______.
(4)若实验过程中50mL量气管中液面的位置如图乙所示,A与B刻度间相差1 mL,刻度A的读数为20,则此时量气管中收集到的气体体积为______.
(5)如果要进一步探究CuO在反应中是否起到催化作用,请完成后续实验.
| 实验步骤 | 实验过程及现象 | 设计目的 |
| 1 | 加入CuO后产生O2的速率比未加入时快得多 | CuO能加快KClO3的分解 |
| 2 | CuO的质量在反应前后是否保持不变 | |
| 3 |
某研究性学习小组欲证明氧化铜也能作为氯酸钾分解反应的催化剂,他们进行了如下实验:

①称取1.0gCuSO4粉末加入10 mL蒸馏水完全溶解;
②将足量的NaOH溶液与上述溶液充分反应,生成蓝色沉淀,过滤后洗涤沉淀;
③将所得沉淀转移到坩埚(一种可用于加热固体物质的容器)中,均匀缓慢加热至完全变为黑色的氧化铜,研细备用;
④按下表中的质量将固体混合好后,在相同条件下加热,并与MnO2的催化效果做比较,实验时间均以生成50 mL气体为准(见图甲),其他可能影响实验的因素均忽略.
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是______(填序号).
(2)写出步骤③的化学方程式______.
(3)表格中的“待测数据”是指______.
(4)若实验过程中50mL量气管中液面的位置如图乙所示,A与B刻度间相差1 mL,刻度A的读数为20,则此时量气管中收集到的气体体积为______.
(5)如果要进一步探究CuO在反应中是否起到催化作用,请完成后续实验.

①称取1.0gCuSO4粉末加入10 mL蒸馏水完全溶解;
②将足量的NaOH溶液与上述溶液充分反应,生成蓝色沉淀,过滤后洗涤沉淀;
③将所得沉淀转移到坩埚(一种可用于加热固体物质的容器)中,均匀缓慢加热至完全变为黑色的氧化铜,研细备用;
④按下表中的质量将固体混合好后,在相同条件下加热,并与MnO2的催化效果做比较,实验时间均以生成50 mL气体为准(见图甲),其他可能影响实验的因素均忽略.
| 编号 | KClO3质量(g) | 其他物质质量(g) | 待测数据 |
| 1 | 2.0 | 不加任何物质 | … |
| 2 | 2.0 | CuO 0.5 | … |
| 3 | 2.0 | MnO2 0.5 | … |
(1)上述实验步骤中需要使用玻璃棒的是______(填序号).
(2)写出步骤③的化学方程式______.
(3)表格中的“待测数据”是指______.
(4)若实验过程中50mL量气管中液面的位置如图乙所示,A与B刻度间相差1 mL,刻度A的读数为20,则此时量气管中收集到的气体体积为______.
(5)如果要进一步探究CuO在反应中是否起到催化作用,请完成后续实验.
| 实验步骤 | 实验过程及现象 | 设计目的 |
| 1 | 加入CuO后产生O2的速率比未加入时快得多 | CuO能加快KClO3的分解 |
| 2 | CuO的质量在反应前后是否保持不变 | |
| 3 |
