摘要:(1)某物质的相对分子质量的计算: 将化学式中所有的原子的相对原子质量加和.即是该物质的相对分子质量.如:Ca(OH)2 答:Mr[Ca(OH)2]=Ar=40+2=74 (2)计算化合物中的原子个数之比: 在化学式中.元素符号右下角的数字就是表示该元素原子的个数.因此这些数字的比值就是化合物中的原子个数. 如:Fe2O3中.铁原子与氧原子个数比就是2:3.碳酸钙CaCO3中钙.碳.氧原子个数比为1:1:3 但注意某些物质的化学式中.同种元素并不写在一起的.这时要注意原子个数. 如:NH4NO3中.氮.氢.氧原子个数比应该为2:4:3 Cu2(OH)2CO3中.铜.碳.氢.氧原子个数比为2:1:2:5 (3)计算化合物中各元素质量之比 在化合物中.各元素质量之比就是各元素的原子个数与它的相对原子质量积之间的比值 如:氯酸钾(KClO3)中.m=39:35.5:16×3=78:71:96 硝酸铵(NH4NO3)中.m=14×2:1×4:16×3=7::1:12 (4)计算一定质量的物质中某元素的质量 某元素的质量=物质的质量×该元素在物质中的质量分数 如:求60gMgSO4中含有氧的质量 m(O)=m(MgSO4)×ω(O)=60g×53.3%=32g 第四章 燃烧 燃料 第一节 燃烧与灭火 教学目的: 知识目标:1.了解燃烧及燃烧的三个条件2.知道自燃和爆炸现象
网址:http://m.1010jiajiao.com/timu3_id_97575[举报]
利用化学方程式可以从量的方面研究物质的变化.如可用稀硫酸和镁反应来测定镁的相对原子质量(设镁的相对原子质量为X).图是某同学设计的测定镁的原子质量的装置(盛放镁条的塑料隔板上有小孔).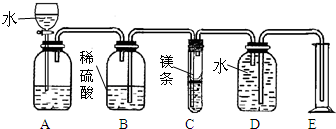
(1)镁与稀硫酸反应的化学方程式为
(2)连接好仪器后,要进行的操作主要有以下几步:①待仪器C中的物质恢复至室温时,测得量身E中水的体积为VmL,换成质量为m1g;②天平上称取质量为m2g的镁条,并将其投入试管C中;③检查装置的气密性;④旋开A上分液漏斗的活塞,当镁条完全溶解时,再关闭活塞.上述几步操作的先后顺序是
(3)由(2)中实验数据,镁的相对原子质量X的计算式为
;
(4)若未将试管C冷却至室温就读取E中水的体积,这将会使测得镁的相对原子质量数据(填“偏高”“偏低”或“无影响”)
查看习题详情和答案>>

(1)镁与稀硫酸反应的化学方程式为
Mg+H2SO4=MgSO4+H2↑
Mg+H2SO4=MgSO4+H2↑
;(2)连接好仪器后,要进行的操作主要有以下几步:①待仪器C中的物质恢复至室温时,测得量身E中水的体积为VmL,换成质量为m1g;②天平上称取质量为m2g的镁条,并将其投入试管C中;③检查装置的气密性;④旋开A上分液漏斗的活塞,当镁条完全溶解时,再关闭活塞.上述几步操作的先后顺序是
③②④①
③②④①
;在A中加入水的目的是将B中的稀硫酸压入C中与镁条反应
将B中的稀硫酸压入C中与镁条反应
.(3)由(2)中实验数据,镁的相对原子质量X的计算式为
| 2m2g |
| m1 |
| 2m2g |
| m1 |
(4)若未将试管C冷却至室温就读取E中水的体积,这将会使测得镁的相对原子质量数据(填“偏高”“偏低”或“无影响”)
偏低
偏低
.19世纪中期,某化学家为测定元素X的相对原子质量,选择了如下的方法:他制备了含有元素X的四种化合物A、B、C、D,并测定出每种化合物中X的质量分数.在250℃时,四种化合物都是气态,将它们分别注入预先抽成真空的四个等容积的烧瓶中,直到每个烧瓶内的压力均达到1.01×105Pa,再称取每个烧瓶的质量,减去空瓶的质量后可得到烧瓶内气体的质量.用氮气重复这一过程,得到如下数据:
请通过计算后确定元素X可能的相对原子质量(要求写出推理过程)(提示:同温同压同体积的气体的分子数相同)
查看习题详情和答案>>
请通过计算后确定元素X可能的相对原子质量(要求写出推理过程)(提示:同温同压同体积的气体的分子数相同)
| 气体 | 气体的质量(g) | 气体中X元素的质量分数(%) |
| N2 | 0.652 | -- |
| A | 0.849 | 97.40 |
| B | 2.398 | 68.98 |
| C | 4.851 | 85.26 |
| D | 3.583 | 92.26 |
19世纪中期,某化学家为测定元素X的相对原子质量,选择了如下的方法:他制备了含有元素X的四种化合物A、B、C、D,并测定出每种化合物中X的质量分数.在250℃时,四种化合物都是气态,将它们分别注入预先抽成真空的四个等容积的烧瓶中,直到每个烧瓶内的压力均达到1.01×105Pa,再称取每个烧瓶的质量,减去空瓶的质量后可得到烧瓶内气体的质量.用氮气重复这一过程,得到如下数据:
请通过计算后确定元素X可能的相对原子质量(要求写出推理过程)(提示:同温同压同体积的气体的分子数相同)
| 气体 | 气体的质量(g) | 气体中X元素的质量分数(%) |
| N2 | 0.652 | -- |
| A | 0.849 | 97.40 |
| B | 2.398 | 68.98 |
| C | 4.851 | 85.26 |
| D | 3.583 | 92.26 |
19世纪中期,某化学家为测定元素X的相对原子质量,选择了如下的方法:他制备了含有元素X的四种化合物A、B、C、D,并测定出每种化合物中X的质量分数.在250℃时,四种化合物都是气态,将它们分别注入预先抽成真空的四个等容积的烧瓶中,直到每个烧瓶内的压力均达到1.01×105Pa,再称取每个烧瓶的质量,减去空瓶的质量后可得到烧瓶内气体的质量.用氮气重复这一过程,得到如下数据:
请通过计算后确定元素X可能的相对原子质量(要求写出推理过程)(提示:同温同压同体积的气体的分子数相同)
查看习题详情和答案>>
请通过计算后确定元素X可能的相对原子质量(要求写出推理过程)(提示:同温同压同体积的气体的分子数相同)
| 气体 | 气体的质量(g) | 气体中X元素的质量分数(%) |
| N2 | 0.652 | -- |
| A | 0.849 | 97.40 |
| B | 2.398 | 68.98 |
| C | 4.851 | 85.26 |
| D | 3.583 | 92.26 |
19世纪中期,某化学家为测定元素X的相对原子质量,选择了如下的方法:他制备了含有元素X的四种化合物A、B、C、D,并测定出每种化合物中X的质量分数.在250℃时,四种化合物都是气态,将它们分别注入预先抽成真空的四个等容积的烧瓶中,直到每个烧瓶内的压力均达到1.01×105Pa,再称取每个烧瓶的质量,减去空瓶的质量后可得到烧瓶内气体的质量.用氮气重复这一过程,得到如下数据:
请通过计算后确定元素X可能的相对原子质量(要求写出推理过程)(提示:同温同压同体积的气体的分子数相同)
查看习题详情和答案>>
请通过计算后确定元素X可能的相对原子质量(要求写出推理过程)(提示:同温同压同体积的气体的分子数相同)
| 气体 | 气体的质量(g) | 气体中X元素的质量分数(%) |
| N2 | 0.652 | -- |
| A | 0.849 | 97.40 |
| B | 2.398 | 68.98 |
| C | 4.851 | 85.26 |
| D | 3.583 | 92.26 |
查看习题详情和答案>>