题目内容
19世纪中期,某化学家为测定元素X的相对原子质量,选择了如下的方法:他制备了含有元素X的四种化合物A、B、C、D,并测定出每种化合物中X的质量分数.在250℃时,四种化合物都是气态,将它们分别注入预先抽成真空的四个等容积的烧瓶中,直到每个烧瓶内的压力均达到1.01×105Pa,再称取每个烧瓶的质量,减去空瓶的质量后可得到烧瓶内气体的质量.用氮气重复这一过程,得到如下数据:请通过计算后确定元素X可能的相对原子质量(要求写出推理过程)(提示:同温同压同体积的气体的分子数相同)
| 气体 | 气体的质量(g) | 气体中X元素的质量分数(%) |
| N2 | 0.652 | -- |
| A | 0.849 | 97.40 |
| B | 2.398 | 68.98 |
| C | 4.851 | 85.26 |
| D | 3.583 | 92.26 |
【答案】分析:同温、同压下同体积的各种气体,其气体的物质的量相等,可以计算出该元素的相对原子质量.
解答:解:(1)根据第一组数据,得到n(N2)= =0.0233 mol,根据同温、同压下同体积的各种气体,其气体的分子数相同,即物质的量相等,故计算如下:(气体摩尔质量/g?mol-1是 1 mol气体中R的质量/g),根据A组数据,得:
=0.0233 mol,根据同温、同压下同体积的各种气体,其气体的分子数相同,即物质的量相等,故计算如下:(气体摩尔质量/g?mol-1是 1 mol气体中R的质量/g),根据A组数据,得: ×97.4%=35.5,根据B组数据,得:
×97.4%=35.5,根据B组数据,得: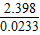 ×68.98%=70.9,根据C组数据,得:
×68.98%=70.9,根据C组数据,得: ×85.26%=177.5,根据D组数据,得:
×85.26%=177.5,根据D组数据,得: ×92.26%=141.8,因70.9≈35.5×2,141.8≈35.5×4,故上述数据中最小的是35.5,其余均为其倍数,又因1mol化合物中至少含1molX原子,故元素X的相对原子质量为35.5.
×92.26%=141.8,因70.9≈35.5×2,141.8≈35.5×4,故上述数据中最小的是35.5,其余均为其倍数,又因1mol化合物中至少含1molX原子,故元素X的相对原子质量为35.5.
故答案为:35.5.
点评:本题是一道相对原子质量的题目,难度较大,是利用同温、同压下同体积的各种气体其气体的物质的量相等进行解答.
解答:解:(1)根据第一组数据,得到n(N2)=
 =0.0233 mol,根据同温、同压下同体积的各种气体,其气体的分子数相同,即物质的量相等,故计算如下:(气体摩尔质量/g?mol-1是 1 mol气体中R的质量/g),根据A组数据,得:
=0.0233 mol,根据同温、同压下同体积的各种气体,其气体的分子数相同,即物质的量相等,故计算如下:(气体摩尔质量/g?mol-1是 1 mol气体中R的质量/g),根据A组数据,得: ×97.4%=35.5,根据B组数据,得:
×97.4%=35.5,根据B组数据,得: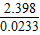 ×68.98%=70.9,根据C组数据,得:
×68.98%=70.9,根据C组数据,得: ×85.26%=177.5,根据D组数据,得:
×85.26%=177.5,根据D组数据,得: ×92.26%=141.8,因70.9≈35.5×2,141.8≈35.5×4,故上述数据中最小的是35.5,其余均为其倍数,又因1mol化合物中至少含1molX原子,故元素X的相对原子质量为35.5.
×92.26%=141.8,因70.9≈35.5×2,141.8≈35.5×4,故上述数据中最小的是35.5,其余均为其倍数,又因1mol化合物中至少含1molX原子,故元素X的相对原子质量为35.5.故答案为:35.5.
点评:本题是一道相对原子质量的题目,难度较大,是利用同温、同压下同体积的各种气体其气体的物质的量相等进行解答.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
19世纪中期,某化学家为测定元素X的相对原子质量,选择了如下的方法:他制备了含有元素X的四种化合物A、B、C、D,并测定出每种化合物中X的质量分数.在250℃时,四种化合物都是气态,将它们分别注入预先抽成真空的四个等容积的烧瓶中,直到每个烧瓶内的压力均达到1.01×105Pa,再称取每个烧瓶的质量,减去空瓶的质量后可得到烧瓶内气体的质量.用氮气重复这一过程,得到如下数据:
请通过计算后确定元素X可能的相对原子质量(要求写出推理过程)(提示:同温同压同体积的气体的分子数相同)
| 气体 | 气体的质量(g) | 气体中X元素的质量分数(%) |
| N2 | 0.652 | -- |
| A | 0.849 | 97.40 |
| B | 2.398 | 68.98 |
| C | 4.851 | 85.26 |
| D | 3.583 | 92.26 |