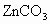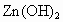摘要:15.锌与足量稀盐酸反应后.溶液中溶质.溶剂分别是 ( ) A.Zn . HCl B.Zn . H2O C.ZnCl2.HCl D.ZnCl2.H2O
网址:http://m.1010jiajiao.com/timu3_id_97021[举报]
27、过量的铁粉与稀盐酸反应,实验时观察到有气泡产生,溶液由无色变成浅绿色.
(1)写出反应的化学方程式
(2)反应后溶液中主要含有Cl-、
(3)从资料中得知:溶液的颜色通常是由溶液中的粒子决定的.由此你认为该反应后溶液呈浅绿色是由
查看习题详情和答案>>
(1)写出反应的化学方程式
Fe+2HCl=H2↑+FeCl2
;(2)反应后溶液中主要含有Cl-、
Fe2+
、H2O
(填粒子符号);(3)从资料中得知:溶液的颜色通常是由溶液中的粒子决定的.由此你认为该反应后溶液呈浅绿色是由
Fe2+
(填粒子符号)表现出来的,验证的实验方案或事实是反应前的盐酸溶液是无色的(或将足量锌放到氯化亚铁溶液中,溶液由浅绿色变为无色;硫酸亚铁溶液为浅绿色且硫酸溶液为无色等)(其他合理答案均可)
.(2007?江西)过量的铁粉与稀盐酸反应,实验时观察到有气泡产生,溶液由无色变成浅绿色.
(1)写出反应的化学方程式
(2)反应后溶液中主要含有Cl-、
(3)从资料中得知:溶液的颜色通常是由溶液中的粒子决定的.由此你认为该反应后溶液呈浅绿色是由
查看习题详情和答案>>
(1)写出反应的化学方程式
Fe+2HCl=H2↑+FeCl2
Fe+2HCl=H2↑+FeCl2
;(2)反应后溶液中主要含有Cl-、
Fe2+
Fe2+
、H20
H20
(填粒子符号);(3)从资料中得知:溶液的颜色通常是由溶液中的粒子决定的.由此你认为该反应后溶液呈浅绿色是由
Fe2+
Fe2+
(填粒子符号)表现出来的,验证的实验方案或事实是反应前的盐酸溶液是无色的或将足量锌放到氯化亚铁溶液中,溶液由浅绿色变为无色
反应前的盐酸溶液是无色的或将足量锌放到氯化亚铁溶液中,溶液由浅绿色变为无色
. 某化学兴趣小组对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究.
某化学兴趣小组对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究.请你参与他们的探究活动,并回答有关问题.
[实验探究]
(1)方案一:某同学按右图所示的方法先向试管中加入约2mL NaOH溶液,再滴入几滴酚酞试液,溶液变红.然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为
无
无
色,证明NaOH溶液与稀盐酸恰好完全反应.①请指出右图操作中的错误
胶头滴管伸入试管内
胶头滴管伸入试管内
.②写出NaOH溶液与稀盐酸反应的化学方程式
HCl+NaOH═NaCl+H2O
HCl+NaOH═NaCl+H2O
;(2)方案二:
| 实验步骤 | 实验现象 | 结论 |
| 取2mL NaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入锌粒 | 若 锌粒表面产生气泡 锌粒表面产生气泡 |
盐酸过量 |
| 若没有明显现象 | NaOH溶液与稀盐酸恰好完全反应 |
(3)方案一在滴入稀盐酸的过程中,若观察到曾有少量气泡出现,请分析产生气泡的原因可能是
部分NaOH吸收空气中的CO2变质为Na2CO3
部分NaOH吸收空气中的CO2变质为Na2CO3
(写出一条即可);(4)有同学提出方案二不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是
盐酸不足时,锌不与NaOH反应,也没有明显现象
盐酸不足时,锌不与NaOH反应,也没有明显现象
.为此,还需要选择石蕊
石蕊
(填一种试剂),再进行实验即可.