网址:http://m.1010jiajiao.com/timu3_id_88941[举报]
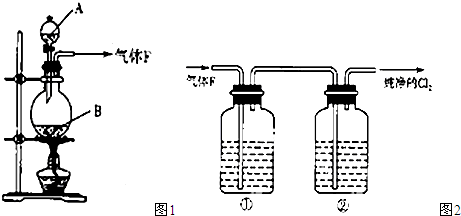
(1)A是浓盐酸,B为二氧化锰,将A滴入B中时发生反应的离子方程式为
(2)甲同学用含有0.2molHCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)小于1.12L,这是由于反应过程中盐酸浓度变小造成的.请列举导致盐酸浓度变小的原因:
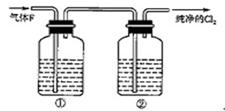
(3)在实验室中,乙同学欲用图2中的装置净化氯气,则瓶①②中应盛放的试剂分别是①
(4)丙同学将纯净的Cl2通入一定量石灰乳中来制取漂白粉,若通入224mL(标准状况下) Cl2完全反应,则反应过程中转移电子的物质的量为
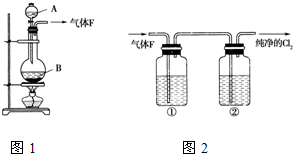
(1)写出仪器名称:A
(2)A是浓盐酸,B为二氧化锰,将A滴入B中时发生反应的离子方程式为
(3)在实验室中,乙同学欲用图2中的装置净化氯气,则瓶①②中应盛放的试剂分别是①
(4)丙同学将纯净的Cl2通入一定量石灰乳中来制取漂白粉,若通入224mL(标准状况下)Cl2完全反应,则反应过程中转移电子的物质的量为
(11分)某校化学实验兴趣小组欲采用如图所示的实验装置制备Cl2,同时进行与氯气有关的某些实验,按要求回答问题。
(1)A是浓盐酸,B为二氧化锰,将A滴入B中时发生反应的离子方程式为______________________________________________;
(2)甲同学用含有0.2molHCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)小于1.12L,这是由于反应过程中盐酸浓度变小造成的。请列举导致盐酸浓度变小的原因:___________________________________________________。
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则瓶①②中应盛放的试剂分别是①_________________________,②_________________________(填试剂名称)。
(4)丙同学将纯净的Cl2通入一定量石灰乳中来制取漂白粉,若通入224mL(标准状况下)Cl2完全反应,则反应过程中转移电子的物质的量为____________________。
查看习题详情和答案>>
(11分)某校化学实验兴趣小组欲采用如图所示的实验装置制备Cl2,同时进行与氯气有关的某些实验,按要求回答问题。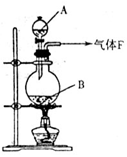
(1)A是浓盐酸,B为二氧化锰,将A滴入B中时发生反应的 离子方程式为______________________________________________;
离子方程式为______________________________________________;
(2)甲同学用含有0.2molHCl的浓盐酸与 足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)小于1.12L,这是由于反应过程中盐酸浓度变小造成的。请列举导致盐酸浓度变小的原因:___________________________________________________。
足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)小于1.12L,这是由于反应过程中盐酸浓度变小造成的。请列举导致盐酸浓度变小的原因:___________________________________________________。
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则瓶①②中应盛放的试剂分别是①_________________________,②_________________________(填试剂名称)。
(4)丙同学将纯净的Cl2通入一定量石灰乳中来制取漂白粉,若通入224mL(标准状况下)Cl2完全反应,则反应过程中转移电子的 物质的量为____________________。
物质的量为____________________。
(17分)某校化学实验兴趣小组欲采用如图所示的实验装置制备Cl2,同时进行与氯气有关的某些实验,按要求回答问题。
(1)A是浓盐酸,B为二氧化锰,将A滴入B中时发生反应的离子方程式为 ;
(2)甲同学用含有0.2molHCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下)小于1.12L,这是由于反应过程中盐酸浓度变小造成的。请列举导致盐酸浓度变小的原因:
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则瓶①②中应盛放的试剂分别是
① ,② (填试剂名称)。
(4)丙同学将纯净的Cl2通入一定量石灰乳中来制取漂白粉,若通入224mL(标准状况下) Cl2完全反应,则反应过程中转移电子的物质的量为 。