摘要:30.(09海南卷20) 20-1-20-3题为选择题.每小题3分.在每小题给出的四个选项中.只有一项是符合题目要求的.20-4题为非选择题.请在答题纸相应位置做答. 20-1.下列有关肥皂的叙述中错误的是: A.肥皂与纯碱的去污原理相同 B.肥皂可以加速油污在水中的分散 C.肥皂是油脂在碱性条件下水解生成的 D.肥皂主要成分的分子中含有亲油基团和亲水基团 20-2.下列使用化肥.农药的描述中正确的是: A.高温多雨时比较适合施用钾肥 B.长期施用硫铵会造成土壤板结 C.石硫合剂必须与硫酸混合后才能施用 D.过磷酸钙必须经硫酸处理后才能施用 20-3.下列有关硬水及其软化的说法中错误的是: A.离子交换法可以软化硬水 B.硬水中含有较多Ca2+.Mg2+ C.生产.生活使用的天然水必须经软化 D.加热可使暂时硬水中的Ca2+生成CaCO3沉淀 20-4 工业上常用氨氧化法生产硝酸.其过程包括氨的催化氧化.一氧化氮的氧化和水吸收二氧化氮生成硝酸.请回答下列问题: (1)氨催化氧化的化学方程式为: (2)原料气中空气必须过量.其主要原因是, (3)将铂铑合金做成薄丝网的主要原因是, (4)水吸收二氧化氮生成硝酸为放热反应.其化学方程式为.为了提高水对二氧化氮的吸收率.可采取的措施为 答案: 20-1A 20-2B 20-3C 20-4 (2)提高氨的转化率和一氧化氮的转化率 (3)增大单位质量的催化剂与反应物的接触面积 (4)加压降温
网址:http://m.1010jiajiao.com/timu3_id_88743[举报]
(2011?崇明县二模)已知N2O4(无色) 2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算20s-40s内用NO2表示的平均反应速率为
(2)反应达到平衡后,将温度升高至100℃,发现颜色加深,则该反应的逆反应是
(3)该反应的平衡常数表示式为K=
(A)向混合气体中通入NO2 (B)使用高效催化剂
(C)升高温度 (D)增大N2O4的起始浓度
(4)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在100℃时N2O4物质的量的变化曲线(反应物起始的物质的量相等).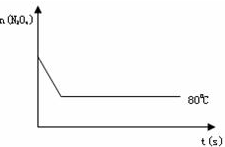
查看习题详情和答案>>
 2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
| n( N2O4 )(mol) | 0.80 | a | 0.40 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.48 | b | 1.04 | 1.20 | 1.20 |
0.004mol/(L?S)
0.004mol/(L?S)
,平衡时N2O4的转化率为75%
75%
.(2)反应达到平衡后,将温度升高至100℃,发现颜色加深,则该反应的逆反应是
放热
放热
(填“放热”或“吸热“)(3)该反应的平衡常数表示式为K=
K=
| c2(NO2) |
| c(N2O4) |
K=
要增大该反应的K值,可采取的措施有(填序号)| c2(NO2) |
| c(N2O4) |
C
C
.(A)向混合气体中通入NO2 (B)使用高效催化剂
(C)升高温度 (D)增大N2O4的起始浓度
(4)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在100℃时N2O4物质的量的变化曲线(反应物起始的物质的量相等).

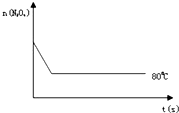 已知N2O4(无色)?2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
已知N2O4(无色)?2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
| n( N2O4 )(mol) | 0.80 | a | 0.40 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.48 | b | 1.04 | 1.20 | 1.20 |
0.004
0.004
mol?L-1?s-1,平衡时N2O4的转化率为75%
75%
(2)计算在80℃时该反应的平衡常数K=
1.8
1.8
mol?L-1;(3)要增大该反应的K值,可采取的措施有(填序号)
C
C
A.向混合气体中通入NO2
B.使用高效催化剂
C.升高温度
D.增大N2O4的起始浓度
(4)反应达到平衡后,将温度升高至100℃,发现颜色加深,则△H
>
>
0(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在100℃时N2O4物质的量的变化曲线(反应物起始的物质的量相等).
我国南方的土壤多呈酸性,现寻找一种较适合南方施用的化肥。现有两种盐,第一种为一元弱酸盐XY,其中HY溶于水,常温下HY溶液中未电离的分子数与电离生成的离子数之比为20∶1;第二种为一元弱碱盐AB,常温时0.1 mol·L-1的AB盐溶液pH=5,植物根系对Y-和A+的吸收量较大。请回答:
(1)常温下HY的电离程度为______________。
(2)常温下AB溶液中起水解反应的A+占全部A的比例为____________。
(3)相比之下,我国南方的土壤适宜使用何种盐,为什么?
(4)XY在生物中称为____________盐。
查看习题详情和答案>>
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用图1-2-20所示的实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。

图1-2-20
(1)a电极材料为__________,其电极反应式为_______________________________。
(2)电解液d可以是__________,则白色沉淀在电极上生成;也可以是__________,则白色沉淀在两极之间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是____________________,在加入苯之前,对d溶液进行加热处理的目的是__________。
(4)为了在短时间内看到白色沉淀,可以采取的措施是__________。
A.改用稀硫酸作电解液 B.适当增大电源电压
C.适当缩小两极间的距离 D.适当降低电解液温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显的现象为__________。
查看习题详情和答案>>已知N2O4(无色)

2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算20s-40s内用NO2表示的平均反应速率为______,平衡时N2O4的转化率为______.
(2)反应达到平衡后,将温度升高至100℃,发现颜色加深,则该反应的逆反应是______(填“放热”或“吸热“)
(3)该反应的平衡常数表示式为K=______要增大该反应的K值,可采取的措施有(填序号)______.
(A)向混合气体中通入NO2 (B)使用高效催化剂
(C)升高温度 (D)增大N2O4的起始浓度
(4)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在100℃时N2O4物质的量的变化曲线(反应物起始的物质的量相等).
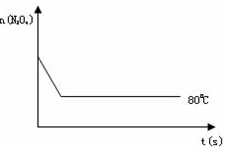
查看习题详情和答案>>

2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
| n( N2O4 )(mol) | 0.80 | a | 0.40 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.48 | b | 1.04 | 1.20 | 1.20 |
(2)反应达到平衡后,将温度升高至100℃,发现颜色加深,则该反应的逆反应是______(填“放热”或“吸热“)
(3)该反应的平衡常数表示式为K=______要增大该反应的K值,可采取的措施有(填序号)______.
(A)向混合气体中通入NO2 (B)使用高效催化剂
(C)升高温度 (D)增大N2O4的起始浓度
(4)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在100℃时N2O4物质的量的变化曲线(反应物起始的物质的量相等).
