题目内容
(2011?崇明县二模)已知N2O4(无色) 2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算20s-40s内用NO2表示的平均反应速率为
(2)反应达到平衡后,将温度升高至100℃,发现颜色加深,则该反应的逆反应是
(3)该反应的平衡常数表示式为K=
(A)向混合气体中通入NO2 (B)使用高效催化剂
(C)升高温度 (D)增大N2O4的起始浓度
(4)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在100℃时N2O4物质的量的变化曲线(反应物起始的物质的量相等).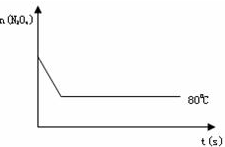
 2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
| n( N2O4 )(mol) | 0.80 | a | 0.40 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.48 | b | 1.04 | 1.20 | 1.20 |
0.004mol/(L?S)
0.004mol/(L?S)
,平衡时N2O4的转化率为75%
75%
.(2)反应达到平衡后,将温度升高至100℃,发现颜色加深,则该反应的逆反应是
放热
放热
(填“放热”或“吸热“)(3)该反应的平衡常数表示式为K=
K=
| c2(NO2) |
| c(N2O4) |
K=
要增大该反应的K值,可采取的措施有(填序号)| c2(NO2) |
| c(N2O4) |
C
C
.(A)向混合气体中通入NO2 (B)使用高效催化剂
(C)升高温度 (D)增大N2O4的起始浓度
(4)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在100℃时N2O4物质的量的变化曲线(反应物起始的物质的量相等).

分析:(1)根据表中数据可得各时间时反应物和生成物的物质的量,以此计算反应速率和转化率;
(2)反应达到平衡后,将温度升高至100℃,发现颜色加深,说明升高温度平衡向正反应方向移动;
(3)反应的平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,要增大该反应的K值,应使平衡向正反应方向移动;
(4)升高温度反应速率增大,平衡右移,平衡时N2O4的物质的量较80℃时少,以此画图.
(2)反应达到平衡后,将温度升高至100℃,发现颜色加深,说明升高温度平衡向正反应方向移动;
(3)反应的平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,要增大该反应的K值,应使平衡向正反应方向移动;
(4)升高温度反应速率增大,平衡右移,平衡时N2O4的物质的量较80℃时少,以此画图.
解答:解:(1)根据表中数据可得各时间时反应物和生成物的物质的量,
N2O4(无色) 2NO2
2NO2
0s时:0.80mol 0
20s时:a 0.48mol
40s时:0.40mol b
80s时:0.20mol 1.20mol
则a=0.80mol-0.24mol=0.56mol;b=0.80mol,
则20s-40s内用NO2表示的平均反应速率为
=0.004mol/(L?S),由表中数据可知,当反应达到80s时反应达到平衡状态,平衡时N2O4的转化率为
×100%=75%,
故答案为:0.004mol/(L?S);75%;
(2)反应达到平衡后,将温度升高至100℃,发现颜色加深,说明升高温度平衡向正反应方向移动,则正反应为吸热反应,逆反应为放热反应,故答案为:放热;
(3)反应的平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,则为K=
,要增大该反应的K值,应使平衡向正反应方向移动,通入 N2O4和NO2都相当于在原来的基础上缩小体积,则压强增大平衡向逆向移动,K值减小,加入催化剂对平衡没有影响,升高温度平衡右移,K值增大,
故答案为:K=
;C;
(4)升高温度反应速率增大,平衡右移,平衡时N2O4的物质的量较8℃0时少,故答案为:图象如图所示.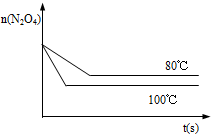
N2O4(无色)
 2NO2
2NO2 0s时:0.80mol 0
20s时:a 0.48mol
40s时:0.40mol b
80s时:0.20mol 1.20mol
则a=0.80mol-0.24mol=0.56mol;b=0.80mol,
则20s-40s内用NO2表示的平均反应速率为
| ||
| 20s |
| 0.8mol-0.2mol |
| 0.8mol |
故答案为:0.004mol/(L?S);75%;
(2)反应达到平衡后,将温度升高至100℃,发现颜色加深,说明升高温度平衡向正反应方向移动,则正反应为吸热反应,逆反应为放热反应,故答案为:放热;
(3)反应的平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,则为K=
| c2(NO2) |
| c(N2O4) |
故答案为:K=
| c2(NO2) |
| c(N2O4) |
(4)升高温度反应速率增大,平衡右移,平衡时N2O4的物质的量较8℃0时少,故答案为:图象如图所示.

点评:本题考查化学平衡移动以及有关计算,题目较为综合,具有一定难度,做题时注意外界条件对化学平衡的影响.

练习册系列答案
相关题目






 (2011?崇明县二模)取等物质量浓度的NaOH 溶液两份甲和乙各100mL,分别向甲、乙中通入不等量的CO2,然后向两溶液中逐滴加入2mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸溶液的体积之间关系如图所示,试回答下列问题:
(2011?崇明县二模)取等物质量浓度的NaOH 溶液两份甲和乙各100mL,分别向甲、乙中通入不等量的CO2,然后向两溶液中逐滴加入2mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸溶液的体积之间关系如图所示,试回答下列问题: