网址:http://m.1010jiajiao.com/timu3_id_88710[举报]
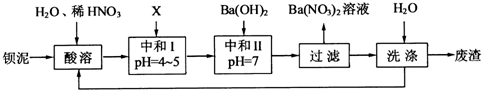
(1)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
(3)该厂结合本厂实际,选用的X为
(4)上述流程中洗涤的目的是
| 阳离子 | K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
| 阴离子 | OH- HCO3- CO32- Cl- NO3- SO42- |
(1)溶液中
(2)原溶液中所含的阴离子为
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧到恒重,得到固体质量为
Ⅱ、钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等].某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下:
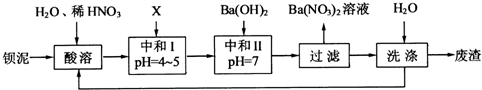
(1)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
(3)该厂结合本厂实际,选用的X为
(4)上述流程中洗涤的目的是
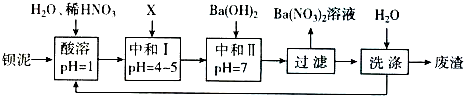
(1)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
(2)酸溶过程中,除发生了BaSO3+2HNO3=Ba(NO3)2+SO2↑+H2O外,BaSO3与HNO3还发生另一个反应,其离子方程式为
(3)结合本厂实际,选用的X为
(4)沉淀转化在生产和科研中具有极其生要的应用.在分析化学中常常先将难溶强酸盐转化为难溶弱酸盐,然后用酸溶解,使阳离子进入溶液.写出BaSO4转化为BaCO3的离子方程式
(1)酸溶过程中会产生CO2、硫酸钡、硅酸.
①二氧化碳与水作用形成的碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式
②硫酸钡是重晶石的主要成分.工业上可以用碳来对重晶石进行处理得到BaS,最终转化成BaCl2.
已知:BaSO4(s)+4C(s)═4CO(s)+BaS(s)△H=571.2KJ/mol
BaSO4(s)+2C(s)═2CO2(s)+BaS(s)△H=226.2KJ/mol
则:C和CO2在高温下反应的热化学方程式为:
(2)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为
(3)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸的原因是
(4)该厂结合本厂实际,选用的X为
(5)上述流程中洗涤的目的是
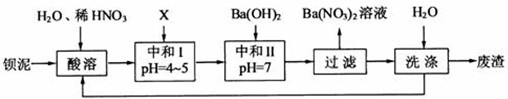
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。钡盐行业生产中排出大量的钡泥[主要含有BaCO3、 BaSO3、 Ba( FeO2)2等],某主要生产BaCO3、 BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:

又已知:
①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③KSP(BaSO4)=1.lxl0-10, KSP(BaCO3)=5.1×10-9.
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理: ______________ 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为:
。
(3)该厂结合本厂实际,选用的X为 (填序号);
A.BaCl2 B.BaCO3 C.Ba(NO3)2 D.Ba(OH)2
(4)中和I使溶液的pH为4~5目的是 ;
结合离子方程式简述原理 。
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是 。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为 。
查看习题详情和答案>>