题目内容
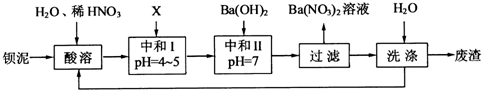
(1)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
(3)该厂结合本厂实际,选用的X为
(4)上述流程中洗涤的目的是
(2)温度越高反应速率越快,故控制温度不超过70℃是为了防止反应速率过快,且浓硝酸越浓越易分解,温度高既易挥发,也易分解,故不用浓硝酸.
(3)X既要能中和硝酸,又不产生新杂质,结合本厂实际,故可用BaCO3;中和Ⅰ使溶液中的Fe3+形成Fe(OH)3沉淀、H+浓度减小;
(4)洗涤废渣是为了减少废渣中可溶性钡盐对环境的污染.
(2)酸溶时控制反应温度不超过70℃,是为了防止温度过高,反应速率太快;不使用浓硝酸,是因为浓HNO3不稳定,易分解,易挥发,故答案为:防止反应速率过快 浓HNO3易挥发、分解(凡合理答案均可);
(3)加入X调节溶液的pH=4~5,则X应能消耗H+,结合工厂主要生产BaCl2、BaCO3、BaSO4的实际情况,可选用BaCO3;中和后溶液中H+浓度减小,pH在4~5时,Fe3+也完全沉淀,故Fe3+浓度也减小,故答案为:BaCO3;Fe3+、H+;
(4)因为钡盐是重金属盐,有毒,故洗涤的目的是减少废渣中可溶性钡盐对环境的污染,故答案为:减少废渣中可溶性钡盐对环境的污染(凡合理答案均可).

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案(2010·江苏常州中学5月)某研究性学习小组在整理实验室化学试剂时,发现一盛有无色钠盐溶液的试剂瓶,标签破损,无法确切知道是哪一种钠盐。某同学根据中学化学知识,对该试剂可能是什么进行了如下猜想和验证,选择你认为完全正确的一项是( )
| 序号 | 猜想物质 | 检验需要试剂 | 操作、现象和结论 |
| A | Na2SO4 | 稀硝酸、氯 化钡溶液 | 取少量该溶液于试管中,滴入稀硝酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液一定是Na2SO4溶液 |
| B | Na2CO3 | 稀盐酸、澄 清石灰水 | 取少量该溶液于试管中,滴入稀盐酸,如果产生的无色气体能使澄清石灰水变浑浊,则原溶液一定是Na2CO3溶液 |
| C | Na2SO3 | 稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,如果产生的气体为无色,则原溶液一定是Na2SO3溶液 |
| D | Na2SiO3 | 过量稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
(2010·江苏常州中学5月)某研究性学习小组在整理实验室化学试剂时,发现一盛有无色钠盐溶液的试剂瓶,标签破损,无法确切知道是哪一种钠盐。某同学根据中学化学知识,对该试剂可能是什么进行了如下猜想和验证,选择你认为完全正确的一项是( )
|
序号 |
猜想物质 |
检验需要试剂 |
操作、现象和结论 |
|
A |
Na2SO4 |
稀硝酸、氯 化钡溶液 |
取少量该溶液于试管中,滴入稀硝酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液一定是Na2SO4溶液 |
|
B |
Na2CO3 |
稀盐酸、澄 清石灰水 |
取少量该溶液于试管中,滴入稀盐酸,如果产生的无色气体能使澄清石灰水变浑浊,则原溶液一定是Na2CO3溶液 |
|
C |
Na2SO3 |
稀盐酸 |
取少量该溶液于试管中,滴入稀盐酸,如果产生的气体为无色,则原溶液一定是Na2SO3溶液 |
|
D |
Na2SiO3 |
过量稀盐酸 |
取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |