题目内容
| 阳离子 | K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
| 阴离子 | OH- HCO3- CO32- Cl- NO3- SO42- |
(1)溶液中
(2)原溶液中所含的阴离子为
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧到恒重,得到固体质量为
Ⅱ、钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等].某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下:
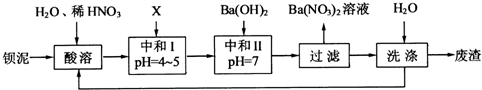
(1)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
(3)该厂结合本厂实际,选用的X为
(4)上述流程中洗涤的目的是
(2)根据离子共存知识来回答;
(3)根据硝酸的氧化性以及亚铁离子的还原性知识来回答;
(4)根据盐的水解以及原子守恒思想来回答;
Ⅱ、(1)Ba(FeO2)2与HNO3反应的化学方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O;
(2)温度越高反应速率越快,故控制温度不超过70℃是为了防止反应速率过快,且浓硝酸越浓越易分解,温度高既易挥发,也易分解,故不用浓硝酸;
(3)X既要能中和硝酸,又不产生新杂质,结合本厂实际,故可用BaCO3;中和Ⅰ使溶液中的Fe3+形成Fe(OH)3沉淀、H+浓度减小;
(4)洗涤废渣是为了减少废渣中可溶性钡盐对环境的污染.
故答案为:一定不;HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化;
(2)若向原溶液中加入足量的盐酸,有无色气体生成,反应后溶液中阴离子种类没有变化,根据表中的离子,可以推知是 Fe2+、NO3-在酸性环境下生成的一氧化氮,所以一定含有氯离子,加入盐酸,溶液中阴离子种类不变,所以原来溶液中含有Cl-,若只含有氯离子和硝酸根离子,二者的量均为1mol,根据电何守恒是不可能的,所以还含有硫酸根离子,再根据电荷守恒确定还含有一种带有两个正电荷的镁离子,故答案为:Cl-、NO3-、SO42-;Fe2+、Mg2+;
(3)向原溶液中加入足量的盐酸,有无色气体NO生成的离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧到恒重,得到固体是三氧化二铁以及氧化镁,根据原子守恒,则生成0.5molFe2O3和1mol的MgO,质量为:0.5mol×160g/mol+1mol×40g/mol=120g,故答案为:120;
Ⅱ、(1)Ba(FeO2)2中Fe元素是+3价,故Ba(FeO2)2与硝酸不发生氧化还原反应,其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O;
(2)酸溶时控制反应温度不超过70℃,是为了防止温度过高,反应速率太快;不使用浓硝酸,是因为浓HNO3不稳定,易分解,易挥发,故答案为:防止反应速率过快 浓HNO3易挥发、分解(凡合理答案均可);
(3)加入X调节溶液的pH=4~5,则X应能消耗H+,结合工厂主要生产BaCl2、BaCO3、BaSO4的实际情况,可选用BaCO3;中和后溶液中H+浓度减小,pH在4~5时,Fe3+也完全沉淀,故Fe3+浓度也减小,故答案为:BaCO3;Fe3+、H+;
(4)因为钡盐是重金属盐,有毒,故洗涤的目的是减少废渣中可溶性钡盐对环境的污染,故答案为:减少废渣中可溶性钡盐对环境的污染(凡合理答案均可).

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案(15分)某种溶液仅含下表离子中的5种(不考虑水的电离与离子的水解),且各种离子的物质的量均为1mol。
| 阳离子 | K+、Ba2+、Fe2+、Al3+、Fe3+、Mg2+ |
| 阴离子 | OH—、HCO3—、CO32—、Cl—、NO3—、SO42— |
若向原溶液中加入足量的盐酸,有气体生成。经分析知:反应后的溶液中的阴离子的种类没有变化。
(1)溶液中 (填“一定”、“一定不”、“可能”)含有HCO3—或CO32—,理由是 。
(2)原溶液中所含的阴离子有 ,阳离子有 。(填离子的符号)
(3)向原溶液中加入足量的盐酸,生成无色气体的离子反应方程式: ;
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,则得到固体的质量为 g。
(15分)某种溶液仅含下表离子中的5种(不考虑水的电离与离子的水解),且各种离子的物质的量均为1mol。
| 阳离子 | K+、Ba2+、Fe2+、Al3+、Fe3+、Mg2+ |
| 阴离子 | OH—、HCO3—、CO32—、Cl—、NO3—、SO42— |
(1)溶液中 (填“一定”、“一定不”、“可能”)含有HCO3—或CO32—,理由是 。
(2)原溶液中所含的阴离子有 ,阳离子有 。(填离子的符号)
(3)向原溶液中加入足量的盐酸,生成无色气体的离子反应方程式: ;
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,则得到固体的质量为 g。
(15分)某种溶液仅含下表离子中的5种(不考虑水的电离与离子的水解),且各种离子的物质的量均为1mol。
|
阳离子 |
K+、Ba2+、Fe2+、Al3+、Fe3+、Mg2+ |
|
阴离子 |
OH—、HCO3—、CO32—、Cl—、NO3—、SO42— |
若向原溶液中加入足量的盐酸,有气体生成。经分析知:反应后的溶液中的阴离子的种类没有变化。
(1)溶液中 (填“一定”、“一定不”、“可能”)含有HCO3—或CO32—,理由是 。
(2)原溶液中所含的阴离子有 ,阳离子有 。(填离子的符号)
(3)向原溶液中加入足量的盐酸,生成无色气体的离子反应方程式: ;
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,则得到固体的质量为 g。
某种溶液仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为1mol。
若向原溶液中加入足量的盐酸,有无色气体生成。经分析反应后溶液中阴离子的种类没有变化。则该溶液含有的离子组成为
| A.Cl-、NO3-、SO42-、Fe2+、Mg2+ | B.HCO3-、Cl-、CO32-、Fe2+、Mg2+ |
| C.SO42-、CO32-、NO3-、Cu2+、Fe2+ | D.Al3+、K+、Cl-、NO3-、SO42- |