摘要:16.工业废水中常含有一定量的Cr2O72-和CrO42-.它们会对人类及生态系统产生很大的伤害.必须进行处理.常用的处理方法有两种. 方法1:还原沉淀法 该法的工艺流程为 其中第①步存在平衡:2CrO42-+2H+Cr2O72-+H2O (1)若平衡体系的pH=2.则溶液显 色. (2)能说明第①步反应达平衡状态的是 . a.Cr2O72-和CrO42-的浓度相同 b.2v (Cr2O72-) =v (CrO42-) c.溶液的颜色不变 (3)第②步中.还原1mol Cr2O72-离子.需要 mol的FeSO4·7H2O. 3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq) 常温下.Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32.要使c(Cr3+)降至10-5mol/L.溶液的pH应调至 . 方法2:电解法 该法用Fe做电极电解含Cr2O72-的酸性废水.随着电解进行.在阴极附近溶液pH升高.产生Cr(OH)3沉淀. (5)用Fe做电极的原因为 . (6)在阴极附近溶液pH升高的原因是 . 溶液中同时生成的沉淀还有 . 解析:(1)pH=2说明溶液显酸性.平衡向正反应方向移动.Cr2O72-的浓度会增大.所以溶液显橙色, (2)在一定条件下的可逆反应里.当正反应速率和逆反应速率相等.反应物的浓度与生成物的浓度不再改变时.该可逆反应就到达化学平衡状态.因此选项a不正确,在任何情况下Cr2O72-和CrO42-的反应速率之比总是满足1:2.因此选项b也不正确,溶液颜色不再改变.这说明Cr2O72-和CrO42-的浓度不再发生改变.因此可以说明反应已经达到化学平衡状态.c正确. (3)Cr2O72-中Cr的化合价是+6价.所以1mol Cr2O72-被还原转移2×(6-3)=6mol电子,Fe2+被氧化生成Fe3+.转移1个电子.因此根据得失电子守恒可知需要FeSO4·7H2O的物质的量为6mol, (4)由溶度积常数的表达式Ksp=c(Cr3+)·c3(OH-)=10-32可知.当c(Cr3+)=10-5mol/L时.c(OH-)=10-9mol/L.所以pH=5. (5) Cr2O72-要生成Cr(OH)3沉淀.必需有还原剂.而铁做电极时.在阳极上可以失去电子产生Fe2+.方程式为Fe-2e-=Fe2+. (6)在电解池中阳离子在阴极得到电子.在溶液中由于H+得电子得能力强于Fe2+的.因此阴极是H+放电.方程式为2H++2e-=H2↑.随着电解的进行.溶液中的H+浓度逐渐降低.水的电离被促进.OH-浓度逐渐升高.由于Fe2+被Cr2O72-氧化生成Fe3+.当溶液碱性达到一定程度时就会产生Fe(OH)3沉淀. 答案:(1)橙 (2)c (3)6 (4)5 (5)阳极反应为Fe-2e-=Fe2+.提供还原剂Fe2+ (6)2H++2e-=H2↑ Fe(OH)3 2010年高考化学试题
网址:http://m.1010jiajiao.com/timu3_id_88611[举报]
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.某工厂使用还原沉淀法处理,该法的工艺流程为:

其中第①步存在平衡:2CrO42-(黄色)+2H+═Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=12,则溶液显
(2)能说明第①步反应达平衡状态的是
a.Cr2O72-的浓度不变 b.Cr2O72-和CrO42-的浓度相同
c.2v(Cr2O72-)=v(CrO42-) d.溶液的颜色不变
(3)第②步反应中,还原剂为
(4)电镀废液中Cr2O72-还可通过下列反应转化:
Cr2O72-(aq)+2Pb2+(aq)+H2O(l)═2PbCrO4(s)+2H+(aq)△H<0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是

查看习题详情和答案>>

其中第①步存在平衡:2CrO42-(黄色)+2H+═Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=12,则溶液显
黄
黄
色.(2)能说明第①步反应达平衡状态的是
ad
ad
.a.Cr2O72-的浓度不变 b.Cr2O72-和CrO42-的浓度相同
c.2v(Cr2O72-)=v(CrO42-) d.溶液的颜色不变
(3)第②步反应中,还原剂为
Fe2+
Fe2+
,该还原剂反应后生成Fe3+
Fe3+
.(4)电镀废液中Cr2O72-还可通过下列反应转化:
Cr2O72-(aq)+2Pb2+(aq)+H2O(l)═2PbCrO4(s)+2H+(aq)△H<0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是
A
A

(2012?奉贤区二模)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.该法的工艺流程如图.

(1)其中第①步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O若平衡体系的pH=2,则溶液显
(2)能说明第①步反应达平衡状态的是
a.Cr2O72-和CrO42-的浓度相同 b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变 d.溶液的pH值不变
(3)第②步中,还原0.01mol Cr2O72-离子,需要
(4)许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H++CrO2-(亮绿色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-
下列有关说法中正确的是
a.加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2-)
b.在一定条件下存在:Cr(OH)3+OH-→CrO2-+2H2O;Cr(OH)3+3H+→Cr3++3H2O
c.Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d.Cr(OH)3(固)在水中的存在三个平衡.
查看习题详情和答案>>

(1)其中第①步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O若平衡体系的pH=2,则溶液显
橙
橙
色.(2)能说明第①步反应达平衡状态的是
cd
cd
.a.Cr2O72-和CrO42-的浓度相同 b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变 d.溶液的pH值不变
(3)第②步中,还原0.01mol Cr2O72-离子,需要
0.06
0.06
mol的FeSO4?7H2O.(4)许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H++CrO2-(亮绿色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-
下列有关说法中正确的是
ab
ab
a.加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2-)
b.在一定条件下存在:Cr(OH)3+OH-→CrO2-+2H2O;Cr(OH)3+3H+→Cr3++3H2O
c.Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d.Cr(OH)3(固)在水中的存在三个平衡.
水是生命之源,广西重金属镉污染事件是2012年1月15日发现的.水污染事件再次提醒人们保护水资源的必要性和紧迫性.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.常用的处理方法有两种.
方法1:还原沉淀法.
该法的工艺流程为:
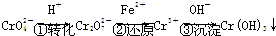
其中第①步存在平衡:
2CrO
(黄色)+2H+?Cr2O
(橙色)+H2O
(1)若平衡体系的 pH=2,该溶液显 色.
(2)能说明第①步反应达平衡状态的是 .(填序号)
A.Cr2O
和CrO
的浓度相同
B.2v(Cr2O
)=v(CrO
)
C.溶液的颜色不变
(3)第②步中,还原 1mol Cr2O72-离子,需要 mol的FeSO4?7H2O.
(4)第 ③步生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3 的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至 .
方法2:电解法.
该法用 Fe 做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生 Cr(OH)3 沉淀.
(5)用Fe做电极的原因为 (用电极反应式解释).
(6)在阴极附近溶液 pH 升高,溶液中同时生成的沉淀还有 .(用化学式表示)
(7)溶液中发生的总反应为(用离子方程式表示) .
查看习题详情和答案>>
方法1:还原沉淀法.
该法的工艺流程为:
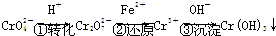
其中第①步存在平衡:
2CrO
2- 4 |
2- 7 |
(1)若平衡体系的 pH=2,该溶液显
(2)能说明第①步反应达平衡状态的是
A.Cr2O
2- 7 |
2- 4 |
B.2v(Cr2O
2- 7 |
2- 4 |
C.溶液的颜色不变
(3)第②步中,还原 1mol Cr2O72-离子,需要
(4)第 ③步生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3 的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至
方法2:电解法.
该法用 Fe 做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生 Cr(OH)3 沉淀.
(5)用Fe做电极的原因为
(6)在阴极附近溶液 pH 升高,溶液中同时生成的沉淀还有
(7)溶液中发生的总反应为(用离子方程式表示)
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.其中一种方法是还原沉淀法
该法的工艺流程为:CrO42-
Cr2O72-
Cr3+
Cr(OH)3↓
其中第步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)若该平衡处在强酸性环境,则溶液显
(2)能说明第①步反应达平衡状态的是
A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq).常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
查看习题详情和答案>>
该法的工艺流程为:CrO42-
| H+ |
| ①转化 |
| Fe3+ |
| ②还原 |
| OH- |
| ③沉淀 |
其中第步存在平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O
(1)若该平衡处在强酸性环境,则溶液显
橙
橙
色.(2)能说明第①步反应达平衡状态的是
C
C
.A.Cr2O72-和CrO42-的浓度相同 B.2v(Cr2O72-)=v(CrO42-) C.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72-离子,需要
6
6
mol的FeSO4?7H2O.写出第②步中反应的离子方程式Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
.(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)?Cr3+(aq)+3OH-(aq).常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
5
5
.工业废水中常含有一定量的Cr2O
和CrO
,它们会对人类及生态系统产生很大损害,必须进行处理.常用的处理方法有两种.
方法1:还原沉淀法
该法的工艺流程为:CrO
Cr2O
Cr3+
Cr(OH)3↓
其中第①步存在平衡:2CrO
(黄色)+2H+?Cr2O
(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显
(2)能说明第①步反应达平衡状态的是
a.Cr2O
和CrO
的浓度相同
b.2v(Cr2O
)=v(CrO
)
c.溶液的颜色不变
(3)第②步中,还原1molCr2O
离子,需要
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)??Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
方法2:电解法
该法用Fe做电极电解含Cr2O
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(5)用Fe作电极的原因为
(6)在阴极附近溶液PH升高的原因是(用电极方程式解释)
查看习题详情和答案>>
2- 7 |
2- 4 |
方法1:还原沉淀法
该法的工艺流程为:CrO
2- 4 |
| H+ |
| ①转化 |
2- 7 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
其中第①步存在平衡:2CrO
2- 4 |
2- 7 |
(1)若平衡体系的pH=2,该溶液显
橙
橙
色.(2)能说明第①步反应达平衡状态的是
c
c
.a.Cr2O
2- 7 |
2- 4 |
b.2v(Cr2O
2- 7 |
2- 4 |
c.溶液的颜色不变
(3)第②步中,还原1molCr2O
2- 7 |
6
6
mol的FeSO4?7H2O.(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)??Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至
5
5
.方法2:电解法
该法用Fe做电极电解含Cr2O
2- 7 |
(5)用Fe作电极的原因为
阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;
阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;
.(6)在阴极附近溶液PH升高的原因是(用电极方程式解释)
2H++2e-═H2↑
2H++2e-═H2↑
.