题目内容
方法1:还原沉淀法.
该法的工艺流程为:
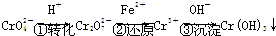
其中第①步存在平衡:
2CrO
2- 4 |
2- 7 |
(1)若平衡体系的 pH=2,该溶液显
(2)能说明第①步反应达平衡状态的是
A.Cr2O
2- 7 |
2- 4 |
B.2v(Cr2O
2- 7 |
2- 4 |
C.溶液的颜色不变
(3)第②步中,还原 1mol Cr2O72-离子,需要
(4)第 ③步生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3 的溶度积Ksp=c(Cr3+)?c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至
方法2:电解法.
该法用 Fe 做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生 Cr(OH)3 沉淀.
(5)用Fe做电极的原因为
(6)在阴极附近溶液 pH 升高,溶液中同时生成的沉淀还有
(7)溶液中发生的总反应为(用离子方程式表示)
(2)得到平衡时,各物质的浓度不变;
(3)根据氧化还原反应中得失电子守恒来计算;
(4)根据溶度积常数以及水的离子积常数来进行计算;
(5)阳极是活性电极时,阳极本身失电子,生成阳离子;
(6)溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,生成沉淀为 Cr(OH)3和Fe(OH)3;
(7)根据反应物和生成物书写离子方程式.
(2)平衡时各物质的浓度不再改变,即溶液的颜色不再改变,故答案为:C;
(3)根据电子得失守恒:n(Cr2O72-)×6=n(FeSO4?7H2O)×1,n(FeSO4?7H2O)=
| 1mol×6 |
| 1 |
(4)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=
| 3 |
| ||
| 10-14 |
| 10-9 |
(5)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+,故答案为:Fe-2e-═Fe2+;
(6)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2的同时,大量产生了OH-,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀,故答案为:Fe(OH)3;
(7)反应物为Cr2O72-和Fe2+,生成Fe(OH)3和Cr(OH)3,反应的离子方程式为6Fe2++Cr2O72-+10OH-+7H2O=6Fe(OH)3↓+2Cr(OH)3↓,
故答案为:6Fe2++Cr2O72-+10OH-+7H2O=6Fe(OH)3↓+2Cr(OH)3↓.

[化学——化学与生活]
下列内容都与人们的生活和健康密切相关,请根据要求填空:
(1)学生要注意合理膳食,注意食品的多样化,防止某种营养成分过多或过少。请回答下列问题:
①大米的主要成分在人体内最终变成了 (填名称)而被人体吸收。
②坏血病是由于缺乏维生素C而引起的,下列有关维生素C的说法正确的是 。
A.维生素C是脂溶性维生素,易在体内积存
B.维生素C可作食品添加剂
C.维生素C虽然被称为抗坏血酸,但![]() 它的水溶液并不呈酸性
它的水溶液并不呈酸性
![]() D.维生素C在水溶液中或受热时很容易被氧化,所以生吃新鲜蔬菜要比熟吃时维生素C的损失少
D.维生素C在水溶液中或受热时很容易被氧化,所以生吃新鲜蔬菜要比熟吃时维生素C的损失少
③蔬菜、水果中维生素C的含量较高,缺乏维生素C的同学在膳食中应该增加蔬菜、水果的摄入量,许多蔬菜、水果(如柠檬酸等)是 (填“酸性食物”或“碱性食物”)。
(2)下表是我国部分城市空气质量周报,阅读并回答下列问题:
| 城市 | 污染 指数 | 首要 污染物 | 空气质量级别 | 城市 | 污染 指数 | 首要[来源:Zxxk.Com] 污染物 | 空气质量级别 |
| 北京 | 92 | TSP | II | 济南 | 76 | TSP | II |
| 天津 | 82 | TSP | II | 武汉 | 83 | NOx | II |
| 哈尔滨 | 96 | TSP | II | 重庆 | 98 | SOx | II |
| 上海 | 74 | NOx | II | 长沙 | 61 | TSP | II |
| 注:TSP——空气中的飘尘 | |||||||
①最容易出现酸雨的城市是______;为减少城市酸雨的产生,可采取以下措施中的 。
A.禁止用煤作燃料
B.改善燃煤质量,限制高硫煤炭的开采
C.向已酸化的土壤中加石灰
D.调整和优化能源结构,加快开发和利用新能源。
②汽车尾气(含有CO、SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装一个催化转换器,其特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,写出CO与NO反应的化学方程式____________________________________________________________。
(3)水是生命之源,动植物的生命活动与其密切相关,回答下列问题:?
①工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法正确的是 。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加氢氧化钠中和 | 中和法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 沉淀法 |
| C | 含苯废水 | 用活性炭吸附 | 物理法 |
| D | 悬浮物 | 加明矾 | 混凝法 |
![]() ②我省湘江流域工厂较多,如果污水处理不当,容易造成工业污染。我国工业废水中几种污染物的最高允许排放浓度如下表:
②我省湘江流域工厂较多,如果污水处理不当,容易造成工业污染。我国工业废水中几种污染物的最高允许排放浓度如下表:
| 污染物 | 汞 | 镉 | 铅 |
| 主要存在形式 | Hg2+ | Cd2+ | Pb2+ |
| 最高允许排放浓度/(mg·dm-3) | 0.05 | 0.1 | 1.0 |
现有某工厂每日排放的污水中汞的质量分数为(1×10-6)%,镉的质量分数为(2×10-5)%,铅的质量分数为(5×10-5)%(设该污水的密度为1 g/cm3)。根据计算该厂三项污染物中 超标。
 。
。
 Cr2O(橙色)+H2O
Cr2O(橙色)+H2O