摘要:14.下图中每一方框代表一种反应物或生成物: (1)若X由M.N两种短周期且同周期元素组成.M原子的最外层电子数比最内层电子数少1.N元素最高正价与它的最低负价代数和为6.反应④的数据如表格所示且D.G在常温下均为气体. C D G 起始 3 mol 1 mol 0 3 min时 2.4 mol 0.8 mol 0.4 mol ①写出反应②的离子方程式 . ②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为 . (2)若X是一种含氧酸盐.B是金属单质.C.D是非金属单质.反应②需要B与A的浓溶液共热才能进行.且生成的E和G是同一种物质.写出反应①的化学方程式 . 1 g固态D在C中完全反应放出9.3 kJ的热量.写出该反应的热化学方程式 . [解析] (1)X的水溶液可电解.X由M.N两种短周期且同周期元素组成.N元素最高正价与它的最低负价代数和为6.可知N为氯元素.由M原子的最外层电子数比最内层电子数少1.可知M为钠元素,那么X的水溶液电解的产物为:H2.Cl2.NaOH.又有A.B反应生成三种产物.C.B反应生成一种产物.可知B必为Cl2.C必为H2.A必为NaOH. 则反应②的离子方程式为:Cl2+2OH-===Cl-+ClO-+H2O.由题意可知F为HCl.由C为H2.结合题中表格中的数据可知:G为NH3.物质G与F反应生成的盐为NH4Cl.其水溶液中离子浓度由大到小的顺序为:c(Cl-)>c(NH)>c(H+)>c(OH-). (2)由B是金属单质.C.D是非金属单质.反应②需要B与A的浓溶液共热才能进行.可知B为Cu.A为硫酸.那么反应①是电解CuSO4.那么E为SO2.C为O2.D为S. [答案] (1)Cl2+2OH-===Cl-+ClO-+H2O c(Cl-)>c(NH)>c(H+)>c(OH-) (2)2CuSO4+2H2O2Cu+2H2SO4+O2↑ S(s)+O2(g)SO2(g),ΔH=-297.6 kJ·mol-1
网址:http://m.1010jiajiao.com/timu3_id_87729[举报]
(8分)下图中每一方框代表一种反应物或生成物: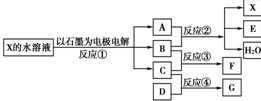
(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6。反应④的数据如表格所示且D、G在常温下均为气体。
| | C | D | G |
| 起始 | 3 mol | 1 mol | 0 |
| 3 min时 | 2.4 mol | 0.8 mol | 0.4 mol |
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为______________。
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质。写出反应①的化学方程式_________。
1 g固态D在C中完全反应放出9.3 kJ的热量,写出该反应的热化学方程式________。 查看习题详情和答案>>
(8分)下图中每一方框代表一种反应物或生成物:

(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6。反应④的数据如表格所示且D、G在常温下均为气体。
①写出反应②的离子方程式___________________________________________。
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为______________。
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质。写出反应①的化学方程式_________。
1 g固态D在C中完全反应放出9.3 kJ的热量,写出该反应的热化学方程式________。

(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6。反应④的数据如表格所示且D、G在常温下均为气体。
| | C | D | G |
| 起始 | 3 mol | 1 mol | 0 |
| 3 min时 | 2.4 mol | 0.8 mol | 0.4 mol |
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为______________。
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质。写出反应①的化学方程式_________。
1 g固态D在C中完全反应放出9.3 kJ的热量,写出该反应的热化学方程式________。
如图中每一方框代表一种反应物或生成物:
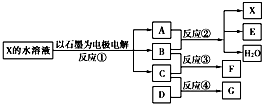
(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6.反应④的数据如表格所示且D、G在常温下均为气体.
①写出反应②的离子方程式
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质.写出反应①的化学方程式
查看习题详情和答案>>

(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6.反应④的数据如表格所示且D、G在常温下均为气体.
| C | D | G | |
| 起始 | 3mol | 1mol | 0 |
| 3min时 | 2.4mol | 0.8mol | 0.4mol |
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
.(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质.写出反应①的化学方程式
2CuSO4+2H2O
2Cu+2H2SO4+O2↑
| ||
2CuSO4+2H2O
2Cu+2H2SO4+O2↑
.1g固态D在C中完全反应放出9.3kJ的热量,写出该反应的热化学方程式
| ||
S(s)+O2(g)=SO2(g)△H=-297.6 kJ?mol-1
S(s)+O2(g)=SO2(g)△H=-297.6 kJ?mol-1
.如图中每一方框代表一种反应物或生成物:
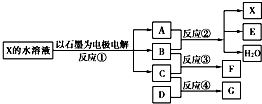
(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6.反应④的数据如表格所示且D、G在常温下均为气体.
| C | D | G | |
| 起始 | 3mol | 1mol | 0 |
| 3min时 | 2.4mol | 0.8mol | 0.4mol |
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为______.
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质.写出反应①的化学方程式______.1g固态D在C中完全反应放出9.3kJ的热量,写出该反应的热化学方程式______. 查看习题详情和答案>>
如图中每一方框代表一种反应物或生成物:

(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6.反应④的数据如表格所示且D、G在常温下均为气体.
①写出反应②的离子方程式______.
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为______.
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质.写出反应①的化学方程式______.1g固态D在C中完全反应放出9.3kJ的热量,写出该反应的热化学方程式______.
查看习题详情和答案>>

(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6.反应④的数据如表格所示且D、G在常温下均为气体.
| C | D | G | |
| 起始 | 3mol | 1mol | 0 |
| 3min时 | 2.4mol | 0.8mol | 0.4mol |
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为______.
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质.写出反应①的化学方程式______.1g固态D在C中完全反应放出9.3kJ的热量,写出该反应的热化学方程式______.