题目内容
如图中每一方框代表一种反应物或生成物:
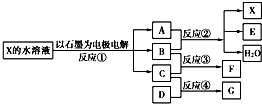
(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6.反应④的数据如表格所示且D、G在常温下均为气体.
①写出反应②的离子方程式______.
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为______.
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质.写出反应①的化学方程式______.1g固态D在C中完全反应放出9.3kJ的热量,写出该反应的热化学方程式______.

(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6.反应④的数据如表格所示且D、G在常温下均为气体.
| C | D | G | |
| 起始 | 3mol | 1mol | 0 |
| 3min时 | 2.4mol | 0.8mol | 0.4mol |
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为______.
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质.写出反应①的化学方程式______.1g固态D在C中完全反应放出9.3kJ的热量,写出该反应的热化学方程式______.
(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,应为Na元素,N元素最高正价与它的最低负价代数和为6,应为Cl元素,则X为NaCl,电解NaCl生成H2、Cl2和NaOH,则A为NaOH,B为Cl2,C为H2,E为NaClO,F为HCl,从起始到3min时反应C(H2)为0.6mol,D为0.2mol,生成G为0.4mol,转化关系为3C(H2)+D→2G,由此可知D为N2,G为NH3,
①反应②为NaOH与Cl2的反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
②物质G与F反应所形成盐为NH4Cl,为强酸弱碱盐,NH4+水解呈酸性,溶液离子浓度大小为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质,应为电解CuSO4的反应,则X为CuSO4,A为H2SO4,B为Cu,C为O2,E、G为SO2,D为S,F为CuO,电解硫酸铜的方程式为2CuSO4+2H2O
2Cu+2H2SO4+O2↑,1g固态S在O2中完全反应放出9.3kJ的热量,则1molS放出的热量为9.3kJ×32=297.6kJ,则热化学方程式为S(s)+O2(g)=SO2(g);△H=-297.6 kJ?mol-1,
故答案为:2CuSO4+2H2O
2Cu+2H2SO4+O2↑;S(s)+O2(g)=SO2(g)△H=-297.6 kJ?mol-1.
①反应②为NaOH与Cl2的反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
②物质G与F反应所形成盐为NH4Cl,为强酸弱碱盐,NH4+水解呈酸性,溶液离子浓度大小为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质,应为电解CuSO4的反应,则X为CuSO4,A为H2SO4,B为Cu,C为O2,E、G为SO2,D为S,F为CuO,电解硫酸铜的方程式为2CuSO4+2H2O
| ||
故答案为:2CuSO4+2H2O
| ||

练习册系列答案
相关题目
如图中每一方框代表一种反应物或生成物:
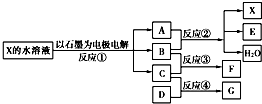
(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6.反应④的数据如表格所示且D、G在常温下均为气体.
| C | D | G | |
| 起始 | 3mol | 1mol | 0 |
| 3min时 | 2.4mol | 0.8mol | 0.4mol |
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为______.
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质.写出反应①的化学方程式______.1g固态D在C中完全反应放出9.3kJ的热量,写出该反应的热化学方程式______.
如图中每一方框代表一种反应物或生成物:
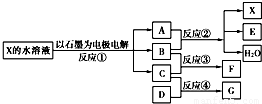
(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6.反应④的数据如表格所示且D、G在常温下均为气体.
①写出反应②的离子方程式 .
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为 .
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质.写出反应①的化学方程式 .1g固态D在C中完全反应放出9.3kJ的热量,写出该反应的热化学方程式 .

(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6.反应④的数据如表格所示且D、G在常温下均为气体.
| C | D | G | |
| 起始 | 3mol | 1mol | |
| 3min时 | 2.4mol | 0.8mol | 0.4mol |
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为 .
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质.写出反应①的化学方程式 .1g固态D在C中完全反应放出9.3kJ的热量,写出该反应的热化学方程式 .


