题目内容
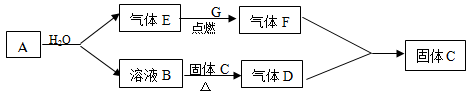
(8分)下图中每一方框代表一种反应物或生成物:

(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6。反应④的数据如表格所示且D、G在常温下均为气体。
①写出反应②的离子方程式___________________________________________。
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为______________。
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质。写出反应①的化学方程式_________。
1 g固态D在C中完全反应放出9.3 kJ的热量,写出该反应的热化学方程式________。

(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6。反应④的数据如表格所示且D、G在常温下均为气体。
| | C | D | G |
| 起始 | 3 mol | 1 mol | 0 |
| 3 min时 | 2.4 mol | 0.8 mol | 0.4 mol |
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为______________。
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质。写出反应①的化学方程式_________。
1 g固态D在C中完全反应放出9.3 kJ的热量,写出该反应的热化学方程式________。
(1)Cl2+2OH-===Cl-+ClO-+H2O
c(Cl-)>c(NH)>c(H+)>c(OH-)
(2)2CuSO4+2H2O 2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑
S(s)+O2(g)= SO2(g);ΔH=-297.6 kJ·mol-1
c(Cl-)>c(NH)>c(H+)>c(OH-)
(2)2CuSO4+2H2O
 2Cu+2H2SO4+O2↑
2Cu+2H2SO4+O2↑S(s)+O2(g)= SO2(g);ΔH=-297.6 kJ·mol-1
试题分析:由转换过程可推知X为NaCl; A为NaOH;B为Cl2;C为H2;F为HCl;E为NaClO;D为N2;G为NH3。
(1)①反应②为氯气与氢氧化钠溶液的反应,其离子方程式为Cl2+2OH-===Cl-+ClO-+H2O
②物质G与F反应所形成盐的化学式为NH4Cl,由于NH4+的水解,因此溶液中各离子的浓度大小为c(Cl-)>c(NH)>c(H+)>c(OH-)。
(2)“若X是一种含氧酸盐,B是金属单质,C、D是非金属单质”则X为CuSO4,因此反应①的化学方程式为:2CuSO4+2H2O2Cu+2H2SO4+O2↑。固态D为S单质,“1 g固态D在C中完全反应放出9.3 kJ的热量”,设1mol S反应放出的热量为
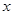 ,可得关系式
,可得关系式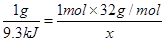 ,解得
,解得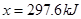 。因此该热化学方程式为:
。因此该热化学方程式为:S(s)+O2(g)= SO2(g);ΔH=-297.6 kJ·mol-1
点评:此题较为综合,考查的知识点较多,属于中档题。对于此类题型,是高考命题的重点。对于离子浓度大小的比较,应注意考虑溶液中离子的水解与电离;热化学方程式的书写应注意化学反应热的计算,尤其是盖斯定律的应用。

练习册系列答案
相关题目
 ;F的化学式是 。
;F的化学式是 。


 、E的化学式
、E的化学式