摘要:7.有a.b.c.d.e五种无色气体.进行下列实验: 实验步骤 实验现象 ①a和b相混合 气体变为红棕色 ②c和d相混合 产生白烟 ③c.e分别通入少量溴水中 都变成无色透明的溶液 ④b.e分别通入氢硫酸中 都产生淡黄色的浑浊 a.b.c.d.e依次可能是( ) A.O2.NO.HCl.NH3.CO2 B.O2.NO.NH3.HCl.SO2 C.NO.O2.NH3.HCl.SO2 D.HBr.Cl2.NH3.H2S.C2H4 [解析] 根据表中所给出的两种气体混合后的现象并结合选项中所给出的气体范围进行分析.①a和b混合后气体变为红棕色.一定是NO和O2混合反应生成NO2,②c和d混合产生白烟.一定是NH3和HCl混合反应生成NH4Cl,③c.e分别通入少量溴水中.溴水变成无色透明的溶液.c.e可能是NH3和SO2.再结合②可知c是NH3.则e是SO2.d就是HCl,④把b.e分别通入氢硫酸中都产生淡黄色浑浊可得出b.e可能是O2和SO2,由③已得出e是SO2.那么b就是O2,结合①可得出a是NO.从而得出a-e依次是NO.O2.NH3.HCl.SO2. [答案] C
网址:http://m.1010jiajiao.com/timu3_id_86865[举报]
有A、B、C、D、E五种短周期元素,它们的核电荷数依次增大.A、D 都能分别与B按原子个数比为1:1 或2:1形成化合物;AC可与EB2反应生成A2B与气态物质EC4;E的M层电子数是K层电子数的2倍.
(1)画出E的原子结构示意图
 ;写出电子式D2B2
;写出电子式D2B2
 ;写出化学式EC4
;写出化学式EC4
(2)比较EB2与EC4的沸点高低(填化学式)
(3)用电子式表示化合物DC的形成过程
 .
.
查看习题详情和答案>>
(1)画出E的原子结构示意图




SiF4
SiF4
.(2)比较EB2与EC4的沸点高低(填化学式)
SiO2
SiO2
>SiF4
SiF4
.(3)用电子式表示化合物DC的形成过程


有A、B、C、D、E五种微粒,其组成均有氢元素,且电子总数为10个,A是双原子的阴离子,它们之间能发生下列变化:
(1)A+B
C+D↑(2)C+C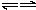 A+E(3)D+E→B+C
A+E(3)D+E→B+C
由此可知它们的化学式分别为:
A
查看习题详情和答案>>
(1)A+B
| △ |
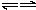 A+E(3)D+E→B+C
A+E(3)D+E→B+C由此可知它们的化学式分别为:
A
OH-
OH-
,BNH4+
NH4+
,CH2O
H2O
,DNH3
NH3
,EH3O+
H3O+
.有A、B、C、D、E五种元素,其中A、B、C、D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为 ;D的价电子排布式图为 ;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
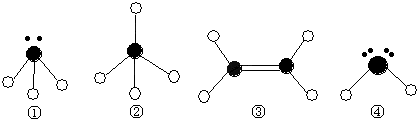
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写分子的化学式); 在③的分子中有 个σ键和 个π键.
(3)A、C、D可形成既具有离子键又具有共价键的化合物,其化学式可能为 ;足量的C的氢化物水溶液与CuSO4 溶液反应生成的配合物,其化学式为 ,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况: .
查看习题详情和答案>>
(1)上述元素中,第一电离能最小的元素的原子结构示意图为
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是
(3)A、C、D可形成既具有离子键又具有共价键的化合物,其化学式可能为
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体.
(1)B、C两元素按原子个数1:1组成的化合物F中的阴阳离子比为
(2)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱(填写化学式):
(3)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的离子方程式:
(4)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应,且生成气体的化学方程式:
(5)D的氢化物分子中,D原子的杂化方式是
查看习题详情和答案>>
(1)B、C两元素按原子个数1:1组成的化合物F中的阴阳离子比为
1:2
1:2
,F中既存在离子键又存在非极性
非极性
共价键(填“极性”或“非极性”).(2)试比较D、E两元素的最高价氧化物对应水化物的酸性强弱(填写化学式):
HClO4
HClO4
>H2SO4
H2SO4
.(3)将E单质通入A、B、C三种元素组成的化合物的水溶液中,写出反应的离子方程式:
Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
.(4)写出两种均含A、B、C、D四种元素的化合物在溶液中相互反应,且生成气体的化学方程式:
NaHSO4+NaHSO3═Na2SO4+H2O+SO2↑
NaHSO4+NaHSO3═Na2SO4+H2O+SO2↑
.(5)D的氢化物分子中,D原子的杂化方式是
sp3
sp3
,空间构型是V形
V形
.有A、B、C、D、E五种短周期元素,其中A、B、C三元素在元素周期表中的位置如图所示,已知A、C两种元素的质子数之和等于B的质子数,B、D、E属于同一周期,D元素原子的最外层只有一个电子,E元素的质子比D元素的质子数多两个.据此填空:
(1)A在元素周期表中的位置为
(2)A的氢化物的结构式为
 ,属于
,属于
(3)C的氢化物的电子式为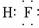
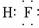 ,由电子式表示D和B所形成的化合物的过程
,由电子式表示D和B所形成的化合物的过程
 .
.
(4)E的氧化物与D的最高价氧化物对应的水化物反应的离子方程式为
查看习题详情和答案>>
(1)A在元素周期表中的位置为
第二周期、第VA族
第二周期、第VA族
,A、B、C、D、E的单质中,氧化性最强的是F2
F2
(写化学式).(2)A的氢化物的结构式为


共价
共价
(填“共价”或“离子”)化合物.(3)C的氢化物的电子式为
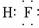
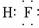


(4)E的氧化物与D的最高价氧化物对应的水化物反应的离子方程式为
2OH-+Al2O3═2AlO2-+H2O
2OH-+Al2O3═2AlO2-+H2O
.
| A | C | |
| B |