摘要:利用光能和光催化剂.可将CO2和H2O(g)转化为CH4和O2.紫外光照射时.在不同催化剂作用下.CH4产量随光照时间的变化如图13所示. (1)在0-30小时内.CH4的平均生成速率VI.VII和VIII从大到小的顺序为 ,反应开始后的12小时内.在第 种催化剂的作用下.收集的CH4最多. (2)将所得CH4与H2O(g)通入聚焦太阳能反应器.发生反应:CH4(g)+H2O(g)CO(g)+3H2(g).该反应的△H=+206 kJ•mol-1. ①在答题卡的坐标图中.画出反应过程中体系的能量变化图 ②将等物质的量的CH4和H2O(g)充入1L恒容密闭容器.某温度下反应达到平衡.平衡常数K=27.此时测得CO的物质的量为0.10mol.求CH4的平衡转化率(计算结果保留两位有效数字). (3)已知:CH4(g)+2O2(g) ===CO2(g)+2H2O(g) △H=-802kJ•mol-1 写出由CO2生成CO的热化学方程式 . 解析:本题考察化学反应速率的概念.计算及外界条件对反应速率对影响,反应热的概念和盖斯定律的计算,热化学方程式的书写,与化学平衡有关的计算,图像的识别和绘制. (1)由图像可以看出.反应进行到30小时时.催化剂Ⅲ生成的甲烷最多.其次是催化剂Ⅱ.催化剂Ⅰ生成的甲烷最少.因此VI.VII和VIII从大到小的顺序为VIII>VII>VI>,同理由图像也可以看出.反应进行到12小时时.催化剂Ⅱ生成的甲烷最多.因此在第Ⅱ种催化剂的作用下.收集的CH4最多. (2)①由热化学方程式可知.该反应是吸热反应.即反应物的总能量小于生成物的总能量.因此反应过程中体系的能量变化图为. (3)由热化学方程式①CH4(g)+H2O(g)CO(g)+3H2(g) △H=+206 kJ•mol-1 ②CH4(g)+2O2(g) ===CO2(g)+2H2O(g) △H=-802kJ•mol-1 ①-②得CO2(g)+3H2O(g) === CO(g)+3H2(g)+2O2(g) △H=+1008 kJ•mol-1 答案:(1)VIII>VII>VI>,Ⅱ (2)① ②91% (3)CO2(g)+3H2O(g) === CO(g)+3H2(g)+2O2(g) △H=+1008 kJ•mol-1
网址:http://m.1010jiajiao.com/timu3_id_86727[举报]
利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4的产量随光照时间的变化如图1所示.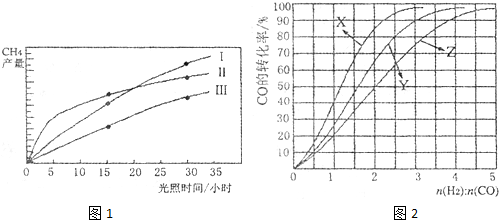
(1)在O?30小时内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)由大到小的顺序为 ;反应开始后的15小时内,在第 种催化剂的作用下,收集的CH4最多.
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ.mol-1.将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10mol,CH4的平衡转化率为91%,则此温度下该反应的平衡常数为 (计算结果取整数).
(3)该反应产生的CO和H2可用来合成可再生能源甲醇,已知CO(g)、CH3OH(l)的燃烧热△H分别为-283.0kJ?mol-1和-726.5kJ?mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 .
(4)工业上常利用反应CO(g)+2H2(g)?CH3OH(g),△H<0合成甲醇,在230℃?270℃最为有利.为研究合成气最合适的起始组成比n(H2):n(CO),分别在230℃、250℃和270℃进行实验,结果如图2.
①270℃的实验结果所对应的曲线是 (填字母);
②230℃时,工业生产适宜釆用的合成气组成n(H2):n(CO)的比值范围是 (填字母).
A.1?1.5 B.2.5?3 C.3.5?4.5
(5)某同学以石墨为电极,以KOH溶液为电解质设计甲醇燃料电池,其负极的电极反应式为 .
查看习题详情和答案>>

(1)在O?30小时内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)由大到小的顺序为
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ.mol-1.将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10mol,CH4的平衡转化率为91%,则此温度下该反应的平衡常数为
(3)该反应产生的CO和H2可用来合成可再生能源甲醇,已知CO(g)、CH3OH(l)的燃烧热△H分别为-283.0kJ?mol-1和-726.5kJ?mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为
(4)工业上常利用反应CO(g)+2H2(g)?CH3OH(g),△H<0合成甲醇,在230℃?270℃最为有利.为研究合成气最合适的起始组成比n(H2):n(CO),分别在230℃、250℃和270℃进行实验,结果如图2.
①270℃的实验结果所对应的曲线是
②230℃时,工业生产适宜釆用的合成气组成n(H2):n(CO)的比值范围是
A.1?1.5 B.2.5?3 C.3.5?4.5
(5)某同学以石墨为电极,以KOH溶液为电解质设计甲醇燃料电池,其负极的电极反应式为
(1)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如图1所示(实线).图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol.
①下列时间段平均反应速率最大的是
A.0~1min B.1~3min C.3~8min D.8~11min

②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验改变的条件是
(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图2所示.在0~30h内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)从大到小的顺序为
查看习题详情和答案>>
①下列时间段平均反应速率最大的是
A
A
,最小的是D
D
.A.0~1min B.1~3min C.3~8min D.8~11min

②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验改变的条件是
升高温度
升高温度
,曲线Ⅱ对应的实验改变的条件是增大压强或者是增大CO2浓度
增大压强或者是增大CO2浓度
.(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图2所示.在0~30h内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)从大到小的顺序为
v(Ⅲ)>v(Ⅱ)>v(Ⅰ)
v(Ⅲ)>v(Ⅱ)>v(Ⅰ)
.反应开始后的12小时内,在第Ⅱ
Ⅱ
种催化剂的作用下,收集的CH4最多. (2011?广东)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图所示.
(2011?广东)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图所示.(1)在0-30小时内,CH4的平均生成速率VⅠ、VⅡ和VⅢ从大到小的顺序为
VⅢ>VⅡ>VⅠ
VⅢ>VⅡ>VⅠ
;反应开始后的12小时内,在第
Ⅱ
Ⅱ
种催化剂的作用下,收集的CH4最多.(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g),该反应的△H=+206kJ?mol-1
①在答题卡的坐标图中,画出反应过程中体系的能量变化图(进行必要的标注)
②将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结果保留两位有效数字)
(3)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802kJ?mol-1
写出由CO2生成CO的热化学方程式
CO2(g)+3H2O(g)═2O2(g)+CO(g)+3H2(g)△H=+1008 kJ?mol-1
CO2(g)+3H2O(g)═2O2(g)+CO(g)+3H2(g)△H=+1008 kJ?mol-1
.(2012?江苏三模)合理地固定和利用CO2能有效减少空气中的温室气体,产物还能造福人类.
(1)11km深海底的无脊椎动物依靠化学自养菌,以海底热泉喷出液中的H2S和CO2合成(C6H10O5)n和一种淡黄色固体,该反应的化学方程式为
(2)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
2CH3OH(g)?H3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
①反应2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)的△H=
②一定条件下用CO2和H2合成二甲醚,反应物气流量对CO2的转化率、二甲醚选择性的影响结果如下图所示.控制气流量为28mL?min-1,生产0.3mol二甲醚需通入CO2的物质的量为
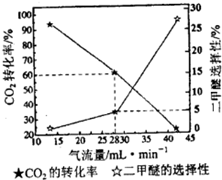
③反应2CH3OH(g)?CH3OCH3(g)+H2O(g)在T℃时的平衡常数为400.该温度下,在密闭容器中加入CH3OH,t时刻时,测得c(CH3OH)=0.03mol?L -1,c(CH3OCH3)=0.6mol?L -1,此时v正
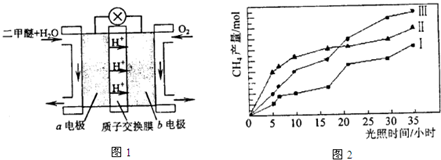
④二甲醚燃料电池的工作原理如图1所示.该电池工作时,a电极的反应式为
(3)一种“碳捕捉”技术为:将含CO2的工业尾气通过NaOH溶液,在所得溶液中加CaO,充分反应后过滤,滤渣高温分解得到的高浓度CO2可用于制备甲醇等.该技术电可以循环使用的物质为
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图2所示.在0~30小时内,CH4的半均生成速率v(Ⅰ)、v(Ⅱ)、和v(Ⅲ)、从大到小的顺序为
查看习题详情和答案>>
(1)11km深海底的无脊椎动物依靠化学自养菌,以海底热泉喷出液中的H2S和CO2合成(C6H10O5)n和一种淡黄色固体,该反应的化学方程式为
12nH2S+6nCO2=C6H10O5)n+12nS↓+7nH2O
12nH2S+6nCO2=C6H10O5)n+12nS↓+7nH2O
.(2)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
2CH3OH(g)?H3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
①反应2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)的△H=
-121.5kJ/mol
-121.5kJ/mol
.②一定条件下用CO2和H2合成二甲醚,反应物气流量对CO2的转化率、二甲醚选择性的影响结果如下图所示.控制气流量为28mL?min-1,生产0.3mol二甲醚需通入CO2的物质的量为
20mol
20mol
.
③反应2CH3OH(g)?CH3OCH3(g)+H2O(g)在T℃时的平衡常数为400.该温度下,在密闭容器中加入CH3OH,t时刻时,测得c(CH3OH)=0.03mol?L -1,c(CH3OCH3)=0.6mol?L -1,此时v正
=
=
v逆(填“>”、“<”或“等于”)④二甲醚燃料电池的工作原理如图1所示.该电池工作时,a电极的反应式为
CH3OCH3+3H2O-12e-=2CO2+12H+
CH3OCH3+3H2O-12e-=2CO2+12H+
.(3)一种“碳捕捉”技术为:将含CO2的工业尾气通过NaOH溶液,在所得溶液中加CaO,充分反应后过滤,滤渣高温分解得到的高浓度CO2可用于制备甲醇等.该技术电可以循环使用的物质为
氧化钙和氢氧化钠
氧化钙和氢氧化钠
.(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图2所示.在0~30小时内,CH4的半均生成速率v(Ⅰ)、v(Ⅱ)、和v(Ⅲ)、从大到小的顺序为
v(Ⅲ)>v(Ⅱ)>v(Ⅰ)
v(Ⅲ)>v(Ⅱ)>v(Ⅰ)
.
 利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图13所示。
利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I,II,III)作用下,CH4产量随光照时间的变化如图13所示。
(1)在0-30小时内,CH4的平均生成速率vI、vII和vIII从大到小的顺序为 ;反应开始后的12小时内,在第 种催化剂的作用下,收集的CH4最多。
(2)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g).该反应的△H=+206 kJ•mol-1
CO(g)+3H2(g).该反应的△H=+206 kJ•mol-1
①在答题卡的坐标图中,画出反应过程中体系的能量变化图(进行必要的标注)
②将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率(计算结果保留两位有效数字)。
(3)已知:CH4(g)+2O2(g) ===CO2(g)+2H2O(g) △H=-802kJ•mol-1
写出由CO2生成CO的化学方程式
查看习题详情和答案>>