题目内容
铜单质及其化合物在很多领域有重要的用途.如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和CuCl2都是重要的化工原料,常用作颜料、防腐剂和消毒剂等.
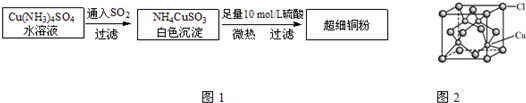
Ⅰ.超细铜粉的某制备方法如图1:
(1)N、O、S三种元素的第一电离能由大到小顺序为
(2)化合物NH4CuSO3中,金属阳离子的核外电子排布式为
(3)化合物Cu(NH3)4SO4中,N原子的杂化方式为
Ⅱ.氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀.
(4)写出上述制备CuCl的离子方程式
(5)CuCl的晶胞结构如图2所示,其中Cl原子的配位数为
(6)CuCl的熔点比CuO的熔点
Ⅰ.超细铜粉的某制备方法如图1:

(1)N、O、S三种元素的第一电离能由大到小顺序为
N>O>S
N>O>S
.(2)化合物NH4CuSO3中,金属阳离子的核外电子排布式为
1S22S22P63S23P63d10
1S22S22P63S23P63d10
.(3)化合物Cu(NH3)4SO4中,N原子的杂化方式为
SP3杂化
SP3杂化
,SO42-的空间构型为正四面体
正四面体
.Ⅱ.氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀.
(4)写出上述制备CuCl的离子方程式
2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-
| ||
2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-
.
| ||
(5)CuCl的晶胞结构如图2所示,其中Cl原子的配位数为
4
4
.(6)CuCl的熔点比CuO的熔点
低
低
(选填“高”或“低”).分析:Ⅰ(1)同一周期元素的第一电离能随着原子序数的增大呈增大趋势,氮元素2p能级处于半满稳定状态,能量低.
(2)化合物NH4CuSO3中铜为+1价,核外有28个电子,根据核外电子排布规律书写Cu+核外电子排布式.
(3)NH3中氮原子呈3个N-H键,氮原子还有1对孤对电子对,杂化轨道数为4;SO42-中硫原子的价电子层电子对数为
=4.
Ⅱ(4)CuCl2溶液中通入一定量SO2,微热生成CuCl沉淀,铜元素化合价由+2价降低为+1价,硫元素被氧化,二氧化硫被氧化为硫酸.
(4)由CuCl的晶胞结构可知,铜原子中周围有4个氯原子,Cu的配位数为4,根据化学式可知Cl的配位数也为4.
(5)CuCl和CuO都是离子晶体,离子的半径越小,所带电荷越多,晶格能越大,熔点就越高,
(2)化合物NH4CuSO3中铜为+1价,核外有28个电子,根据核外电子排布规律书写Cu+核外电子排布式.
(3)NH3中氮原子呈3个N-H键,氮原子还有1对孤对电子对,杂化轨道数为4;SO42-中硫原子的价电子层电子对数为
| 6+2 |
| 2 |
Ⅱ(4)CuCl2溶液中通入一定量SO2,微热生成CuCl沉淀,铜元素化合价由+2价降低为+1价,硫元素被氧化,二氧化硫被氧化为硫酸.
(4)由CuCl的晶胞结构可知,铜原子中周围有4个氯原子,Cu的配位数为4,根据化学式可知Cl的配位数也为4.
(5)CuCl和CuO都是离子晶体,离子的半径越小,所带电荷越多,晶格能越大,熔点就越高,
解答:解:Ⅰ(1)同一周期元素的第一电离能随着原子序数的增大呈增大趋势,氮元素2p能级处于半满稳定状态,能量低,氮元素的第一电离能高于同周期相邻元素第一电离能,所以第一电离能 N>O>S.
故答案为:N>O>S.
(2)化合物NH4CuSO3中铜为+1价,核外有28个电子,铜是29号元素,根据能量最低原理其态原子的电子排布式为1s22s22p63s23p63d104s1或,该原子失去一个电子时,生成亚铜离子,失去的电子是最外层电子,所以亚铜离子的基态的电子排布式为:1S22S22P63S23P63d10.
故答案为:1S22S22P63S23P63d10.
(3)NH3中氮原子呈3个N-H键,氮原子还有1对孤对电子对,杂化轨道数为4,所以氮原子采取SP3杂化.SO42-中硫原子的价电子层电子对数为
=4.孤电子对数为0,所以SO42-是正四面体.
故答案为:SP3杂化;正四面体.
Ⅱ(4)CuCl2溶液中通入一定量SO2,微热生成CuCl沉淀,铜元素化合价由+2价降低为+1价,硫元素被氧化,二氧化硫被氧化为硫酸.所以该反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O
2CuCl↓+4H++SO42-.
故答案为:2Cu2++2Cl-+SO2+2H2O2CuCl↓+4H++SO42-
(5)从CuCl的晶胞可以判断,每个铜原子与4个Cl距离最近且相等,即Cu的配位数为4,根据化学式可知Cl的配位数也为4.
故答案为:4.
(6)CuCl和CuO都是离子晶体,离子晶体中晶格能越大,熔点越高,晶格能与离子的半径和电荷有关,离子的半径越小,所带电荷越多,晶格能越大,熔点就越高,CuCl中氯离子半径大于CuO的中氧离子半径,CuCl中氯离子所带电荷小于CuO中氧离子所带电荷,所以CuCl的熔点比CuO的熔点低.
故答案为:低.
故答案为:N>O>S.
(2)化合物NH4CuSO3中铜为+1价,核外有28个电子,铜是29号元素,根据能量最低原理其态原子的电子排布式为1s22s22p63s23p63d104s1或,该原子失去一个电子时,生成亚铜离子,失去的电子是最外层电子,所以亚铜离子的基态的电子排布式为:1S22S22P63S23P63d10.
故答案为:1S22S22P63S23P63d10.
(3)NH3中氮原子呈3个N-H键,氮原子还有1对孤对电子对,杂化轨道数为4,所以氮原子采取SP3杂化.SO42-中硫原子的价电子层电子对数为
| 6+2 |
| 2 |
故答案为:SP3杂化;正四面体.
Ⅱ(4)CuCl2溶液中通入一定量SO2,微热生成CuCl沉淀,铜元素化合价由+2价降低为+1价,硫元素被氧化,二氧化硫被氧化为硫酸.所以该反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O
| ||
故答案为:2Cu2++2Cl-+SO2+2H2O2CuCl↓+4H++SO42-
(5)从CuCl的晶胞可以判断,每个铜原子与4个Cl距离最近且相等,即Cu的配位数为4,根据化学式可知Cl的配位数也为4.
故答案为:4.
(6)CuCl和CuO都是离子晶体,离子晶体中晶格能越大,熔点越高,晶格能与离子的半径和电荷有关,离子的半径越小,所带电荷越多,晶格能越大,熔点就越高,CuCl中氯离子半径大于CuO的中氧离子半径,CuCl中氯离子所带电荷小于CuO中氧离子所带电荷,所以CuCl的熔点比CuO的熔点低.
故答案为:低.
点评:本题考查较为综合,涉及电子排布式、分子的立体构型、杂化轨道类型、以及晶体结构分析等知识,题目具有一定难度,本题注意晶胞配位数的判断方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.