摘要:[选修2--化学与技术] A.“接触法 制H2SO4时.催化氧化阶段的反应原理为 B.海水提镁的主要步骤为 C.普通水泥的主要成分是硅酸钙 D.黏土的主要成分是三氧化二铝 20-II工业上可用食盐和石灰石为主要原料.经不同的方法生产纯碱.请回答下列问题: (1)卢布兰芳是以食盐.石灰石.浓硫酸.焦炭为原料.在高温下进行煅烧.再浸取.结晶而制得纯碱. ①食盐和浓硫酸反应的化学方程式为 , ②硫酸钠和焦炭.石灰石反应的化学方程式为 , (2)氨碱法的工艺如下图所示.得到的碳酸氢钠经煅烧生成纯碱. ①图中的中间产物C是 .D ., ②装置乙中发生反应的化学方程式为 , (3)联合制碱法对氨碱法的改进.其优点是 , (4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似.故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾.请结合下图的溶解度(S)随温度变化曲线.分析说明是否可行? .
网址:http://m.1010jiajiao.com/timu3_id_86413[举报]
(2012?开封一模)[选修2-化学与技术]合成氨的流程示意图如下:

回答下列问题:
(1)设备A中含有电加热器,触媒和热交换器,其中发生的化学反应方程式为
(2)设备B中m和n是两个通水口,入水口是
(3)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是
(4)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
①依据上表信息,你认为采用
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ/mol;
2CO2(g)+O2(g)═CO2(g)△H=-566kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
(5)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的理由:
查看习题详情和答案>>

回答下列问题:
(1)设备A中含有电加热器,触媒和热交换器,其中发生的化学反应方程式为
N2+3H2
2NH3
| 催化剂 |
| 高温高压 |
N2+3H2
2NH3
,设备A的名称是| 催化剂 |
| 高温高压 |
合成塔
合成塔
;(2)设备B中m和n是两个通水口,入水口是
n
n
(填“m”或“n”).不宜从相反方向通水的原因是高温气体从冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好
高温气体从冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好
;(3)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是
液化
液化
,分馏
分馏
;(4)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J?t-1 | 28109 | 38109 | 48109 |
天然气
天然气
为原料最好;②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
CH4+H2O
CO+3H2
| ||
| 催化剂 |
CH4+H2O
CO+3H2
;
| ||
| 催化剂 |
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ/mol;
2CO2(g)+O2(g)═CO2(g)△H=-566kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
C(S)+H2O(g)
CO(g)+H2(g) △H=+131KJ/mol
| ||
C(S)+H2O(g)
CO(g)+H2(g) △H=+131KJ/mol
;
| ||
(5)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的理由:
移走氨气,减小生成物浓度,平衡右移,有利于氨合成
移走氨气,减小生成物浓度,平衡右移,有利于氨合成
.(2011?丹东模拟)[化学-选修2化学与技术]硫酸工业在国民经济中占有极其重要的地位.请回答硫酸工业中的如下问题:
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫磺为原料,以硫磺为原料的优点是
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3由一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%;O211%;N282)利用表中数据分析,在实际生产中选择的适宜生产条件是:
温度
(3)选择适宜的催化剂,是否可以提高SO2的转化率?
(4)为提高SO3吸收率,实际生产中通常用
(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是
A.保护环境,防止空气污染
B.充分利用热量,降低生产成本
C.升高温度,提高SO2的转化率
D.防止催化剂中毒
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用
查看习题详情和答案>>
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫磺为原料,以硫磺为原料的优点是
生产流程短,设备简单,三废治理量小,劳动生产率高,易于设备大型化等
生产流程短,设备简单,三废治理量小,劳动生产率高,易于设备大型化等
.(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3由一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%;O211%;N282)利用表中数据分析,在实际生产中选择的适宜生产条件是:
温度
400℃~500℃
400℃~500℃
℃,压强0.1
0.1
MPa.| 压强/Mpa 转化率/% 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
否
否
(填“是”或“否”),是否可以增大该反应所放出的热量?否
否
(填“是”或“否”).(4)为提高SO3吸收率,实际生产中通常用
98%的浓硫酸
98%的浓硫酸
吸收SO3.(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是
B
B
(填写序号)A.保护环境,防止空气污染
B.充分利用热量,降低生产成本
C.升高温度,提高SO2的转化率
D.防止催化剂中毒
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用
石灰水
石灰水
(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式SO2+Ca(OH)2═CaSO3↓+H2O、CaSO3+H2SO4═CaSO4+SO2↑+H2O
SO2+Ca(OH)2═CaSO3↓+H2O、CaSO3+H2SO4═CaSO4+SO2↑+H2O
.【化学一选修2化学与技术】
晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等.以下是工业上制取纯硅的一种方法.
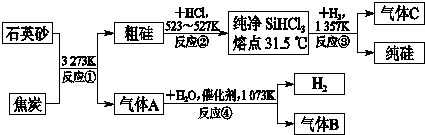
请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有 (填反应代号).
(2)利用反应③能制得纯硅的原因是 .
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂.将石英砂和纯碱按一定比例混合加热至1373~1623K反应,生成化合物W,其化学方程式是 .
(4)A、B、C三种气体在生产过程中可循环使用的是 (写化学式);在“节能减排”中作为减排目标的一种气体是 (写化学式);分别通入W溶液中能得到白色沉淀的气体是 (写化学式).
(5)工业上合成氨的原料H2是先将焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为 、 、 .
(6)反应生成的气体只是A而不是B的原因是 .
查看习题详情和答案>>
晶体硅是信息科学和能源科学中的一种重要材料,可用于制芯片和太阳能电池等.以下是工业上制取纯硅的一种方法.

请回答下列问题(各元素用相应的元素符号表示):
(1)在上述生产过程中,属于置换反应的有
(2)利用反应③能制得纯硅的原因是
(3)化合物W的用途很广,通常可用作建筑工业和造纸工业的黏合剂,可作肥皂的填充剂,是天然水的软化剂.将石英砂和纯碱按一定比例混合加热至1373~1623K反应,生成化合物W,其化学方程式是
(4)A、B、C三种气体在生产过程中可循环使用的是
(5)工业上合成氨的原料H2是先将焦炭与水蒸气反应生成水煤气,再提纯水煤气得到纯净的H2,提纯水煤气得到纯净的H2的化学方程式为
(6)反应生成的气体只是A而不是B的原因是
【化学选修2-化学与技术】
工业生产纯碱的工艺流程示意图如下:

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式为 .
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是 (填化学式),原因是 .
(3)通入C和D气体后发生反应的化学方程式是 .
(4)④过滤后,向滤液中通入氨气,加入细小食盐颗粒,析出副产品 (填化学式),通氨气与加入细小食盐颗粒的作用是 .
(5)写出⑤煅烧发生反应的化学方程式: .产品纯碱中含有碳酸氢钠.若用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数ω(NaHCO3)= (注明表达式中所用的有关符号的含义).
查看习题详情和答案>>
工业生产纯碱的工艺流程示意图如下:

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(A来源于石灰窑厂),则B的化学式为
(2)②过滤后滤液中要通入C和D气体,则先通入的C气体是
(3)通入C和D气体后发生反应的化学方程式是
(4)④过滤后,向滤液中通入氨气,加入细小食盐颗粒,析出副产品
(5)写出⑤煅烧发生反应的化学方程式:
【化学--选修2化学与技术】
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.请回答下列问题:
(1)天然水中溶解的气体主要有 、 (填化学式).
(2)检验蒸馏水的纯度时,最简单易行的方法是测定水的 .
(3)水的净化与软化的区别是:水的净化是用混凝剂(如明矾等)使 ,而水的软化是 .
(4)通过施加一定压力使水分子透过半透膜而将大分子或离子截留,从而使水得以净化的方法称为 ;电渗析法净化水时,使离子通过半透膜的推动力是 .
(5)某天然水中、c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L、c(HCO
)=8×10-4mol/L.要软化10m3这种天然水,需先加入Ca(OH)2 g,再加入Na2CO3 g.
查看习题详情和答案>>
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.请回答下列问题:
(1)天然水中溶解的气体主要有
(2)检验蒸馏水的纯度时,最简单易行的方法是测定水的
(3)水的净化与软化的区别是:水的净化是用混凝剂(如明矾等)使
(4)通过施加一定压力使水分子透过半透膜而将大分子或离子截留,从而使水得以净化的方法称为
(5)某天然水中、c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L、c(HCO
- 3 |