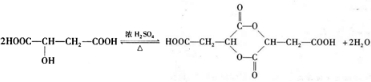
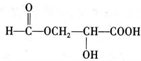
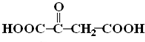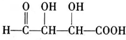题目内容
(2012?开封一模)[选修2-化学与技术]合成氨的流程示意图如下:
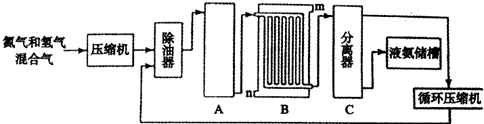
回答下列问题:
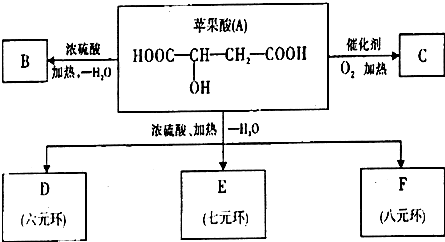
(1)设备A中含有电加热器,触媒和热交换器,其中发生的化学反应方程式为
(2)设备B中m和n是两个通水口,入水口是
(3)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是
(4)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
①依据上表信息,你认为采用
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ/mol;
2CO2(g)+O2(g)═CO2(g)△H=-566kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
(5)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的理由:

回答下列问题:
(1)设备A中含有电加热器,触媒和热交换器,其中发生的化学反应方程式为
N2+3H2
2NH3
| 催化剂 |
| 高温高压 |
N2+3H2
2NH3
,设备A的名称是| 催化剂 |
| 高温高压 |
合成塔
合成塔
;(2)设备B中m和n是两个通水口,入水口是
n
n
(填“m”或“n”).不宜从相反方向通水的原因是高温气体从冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好
高温气体从冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好
;(3)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是
液化
液化
,分馏
分馏
;(4)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J?t-1 | 28109 | 38109 | 48109 |
天然气
天然气
为原料最好;②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
CH4+H2O
CO+3H2
| ||
| 催化剂 |
CH4+H2O
CO+3H2
;
| ||
| 催化剂 |
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ/mol;
2CO2(g)+O2(g)═CO2(g)△H=-566kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
C(S)+H2O(g)
CO(g)+H2(g) △H=+131KJ/mol
| ||
C(S)+H2O(g)
CO(g)+H2(g) △H=+131KJ/mol
;
| ||
(5)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的理由:
移走氨气,减小生成物浓度,平衡右移,有利于氨合成
移走氨气,减小生成物浓度,平衡右移,有利于氨合成
.分析:(1)根据合成氨的工业流程进行解答;
(2)根据冷却的原理和水的重力的影响进行解答;
(3)根据需分离物质的物理性质进行解答;
(4)①依据表中信息进行对比解答;
②根据质量守恒进行解答;
③根据盖斯定律进行解答;
(5)根据影响化学平衡的因素进行解答.
(2)根据冷却的原理和水的重力的影响进行解答;
(3)根据需分离物质的物理性质进行解答;
(4)①依据表中信息进行对比解答;
②根据质量守恒进行解答;
③根据盖斯定律进行解答;
(5)根据影响化学平衡的因素进行解答.
解答:解:(1)合成氨工业流程:原料气制备、原料气净化和压缩、氨的合成、氨的分离,冷凝分离氨气的设备为冷却塔;设备A中含有电加热器,触媒和热交换器,说明发生的化学反应方程式为:N2+3H2
2NH3,设备A的作用是能将氮气和氢气反应,所以设备A的名称是合成塔,
故答案为:N2+3H2
2NH3;合成塔;
(2)为了增强冷却效果,冷却水应从下端进入,逆向冷却效果好,所以入水口为n,故答案为:n;高温气体从冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好;
(3)将液氨和未反应的原料分离,利用空气中氮气的沸点比氧气的沸点低,先将空气加压降温变成液态,然后再加热,使氮气首先从液态空气中蒸发出来,留下的就是液态氧气.故分离方法是液化和分馏,故答案为:液化;分馏;
(4)①根据合成氨厂采用不同原料的相对投资和能量消耗表,天然气相对投资费用1.0,能量消耗28109J?t-1,天然气相对投资费用1.5,能量消耗28109×1.5J?t-1,天然气相对投资费用2.0,能量消耗2×28109J?t-1,相对于重油和煤,天然气为原料最好,故答案为:天然气;
②甲烷在高温、催化剂的作用下与水蒸气反应;生成氢气和一氧化碳,根据题干中提供的反应物和生成物,再根据质量守恒,即可得出CH4+H2O
CO+3H2,
故答案为:CH4+H2O
CO+3H2;
③C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ/mol;A
2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol;B
2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol;C
将ABC三式作如下变换,A-
C-
B可得C(S)+H2O(g)
CO(g)+H2(g) △H=+131KJ/mol,
故答案为:C(S)+H2O(g)
CO(g)+H2(g) △H=+131KJ/mol;
(5)N2+3H2
2NH3,该反应为可逆反应,从化学平衡移动的角度考虑,减少生成物的浓度,化学平衡向正反应方向移动,
故答案为:移走氨气,减小生成物浓度,平衡右移,有利于氨合成.
| 高温高压 |
| 催化剂 |
故答案为:N2+3H2
| 高温高压 |
| 催化剂 |
(2)为了增强冷却效果,冷却水应从下端进入,逆向冷却效果好,所以入水口为n,故答案为:n;高温气体从冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好;
(3)将液氨和未反应的原料分离,利用空气中氮气的沸点比氧气的沸点低,先将空气加压降温变成液态,然后再加热,使氮气首先从液态空气中蒸发出来,留下的就是液态氧气.故分离方法是液化和分馏,故答案为:液化;分馏;
(4)①根据合成氨厂采用不同原料的相对投资和能量消耗表,天然气相对投资费用1.0,能量消耗28109J?t-1,天然气相对投资费用1.5,能量消耗28109×1.5J?t-1,天然气相对投资费用2.0,能量消耗2×28109J?t-1,相对于重油和煤,天然气为原料最好,故答案为:天然气;
②甲烷在高温、催化剂的作用下与水蒸气反应;生成氢气和一氧化碳,根据题干中提供的反应物和生成物,再根据质量守恒,即可得出CH4+H2O
| ||
| 催化剂 |
故答案为:CH4+H2O
| ||
| 催化剂 |
③C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ/mol;A
2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol;B
2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol;C
将ABC三式作如下变换,A-
| 1 |
| 2 |
| 1 |
| 2 |
| ||
故答案为:C(S)+H2O(g)
| ||
(5)N2+3H2
| 高温高压 |
| 催化剂 |
故答案为:移走氨气,减小生成物浓度,平衡右移,有利于氨合成.
点评:本题是一道化学和工业生产联系的题目,主要考查了合成氨工业,掌握合成氨工业的流程和设备,结合化学平衡的原理解答是关键,难度较大.

练习册系列答案
相关题目