网址:http://m.1010jiajiao.com/timu3_id_86304[举报]
 (2011?山东)科研、生产中常涉及钠、硫及其化合物.
(2011?山东)科研、生产中常涉及钠、硫及其化合物.(1)实验室用无水乙醇处理少量残留的金属钠,化学方程式为
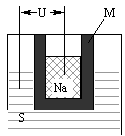
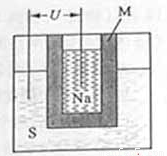
(2)如图为钠硫高能电池的结构示意图.该电池的工作温度为200℃左右,电池反应为
2Na+xS=Na2Sx,正极的电极反应式为
(3)Na2S溶液中离子浓度由达到小的顺序为
科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为 。要清洗附着在试管壁上的硫,可用的试剂是 。
(2)右图为钠硫高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+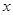 S=Na2
S=Na2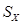 ,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的
倍。
,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的
倍。
(3)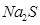 溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体
溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体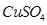 ,溶液Ph (填“增大”“减小”或“不变”),
,溶液Ph (填“增大”“减小”或“不变”),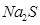 溶液长期放置有硫析出,原因为
(用离子方程式表示)。
溶液长期放置有硫析出,原因为
(用离子方程式表示)。
查看习题详情和答案>>
科研、生产中常涉及钠、硫及其化合物。
(1)工业上用Na2CO3溶液处理水垢中的CaSO4,反应的离子方程式为___________________;实验室中,Na2S溶液长期放置有硫析出,原因为___________________(用离子方程式表示)。
(2)下图是大型蓄电系统的示意图。左右两侧为电解质储罐,中央为电池,反应原理为: ,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
,电解质通过泵在储罐和电池间循环;离子选择性膜只允许钠离子通过。
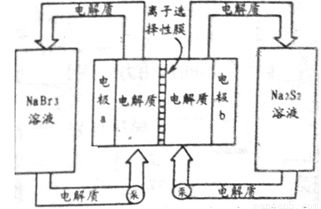
当蓄电池放电时,电池中Na+的移动方向是_________(填“a→b”或“b→a”),电极a的电极反应式为_______________;当蓄电池处于充电状态时,电极b的电极反应式为___________。用该电池做电源,采用惰性电极电解200 mL 1 mol·L-1的AgNO3溶液,当阴极质量增加2.16 g时,电解后溶液的pH为_________(不考虑溶液体积变化)。
(3)工业上,用Na2SO3溶液作为吸收液可吸收烟气中的SO2,吸收SO2过程中,溶液pH与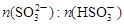 关系如下表:
关系如下表:
|
|
91∶9 |
1∶1 |
9∶91 |
|
pH(25℃) |
8.2 |
7.2 |
6.2 |
①由上表判断,NaHSO3溶液显________性,用平衡原理解释:__________________。
②当溶液呈中性时,溶液中离子浓度的大小关系为_____________________________。
查看习题详情和答案>>
科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为___________________________________。要清洗附着在试管壁上的硫,可用的试剂是________。
(2)右图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为______________________。M(由Na2O和Al2O3制得)的两个作用是_______________________、_______________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的_______倍。

(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为______________________。要清洗附着在试管壁上的硫,可用的试剂是______________________。
(2)右图为钠硫高能电池的结构示意图,该电池的工作温度为320°C左右,电池反应为2Na+xS = NaSx,正极的电极反应式为________________________。M(由NaO和AlO制得)的两个作用是______________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。