��Ŀ����
���С������г��漰�ơ����仯���
��1����ҵ����Na2CO3��Һ����ˮ���е�CaSO4����Ӧ�����ӷ���ʽΪ___________________��ʵ�����У�Na2S��Һ���ڷ�������������ԭ��Ϊ___________________�������ӷ���ʽ��ʾ����
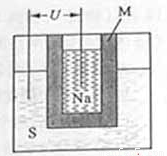
��2����ͼ�Ǵ������ϵͳ��ʾ��ͼ����������Ϊ����ʴ��ޣ�����Ϊ��أ���Ӧԭ��Ϊ�� �������ͨ�����ڴ��͵�ؼ�ѭ��������ѡ����Ĥֻ����������ͨ����
�������ͨ�����ڴ��͵�ؼ�ѭ��������ѡ����Ĥֻ����������ͨ����
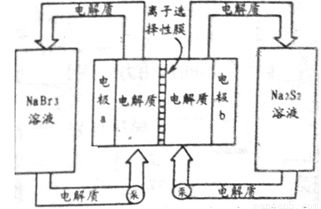
�����طŵ�ʱ�������Na+���ƶ�������_________���a��b����b��a�������缫a�ĵ缫��ӦʽΪ_______________�������ش��ڳ��״̬ʱ���缫b�ĵ缫��ӦʽΪ___________���øõ������Դ�����ö��Ե缫���200 mL 1 mol��L��1��AgNO3��Һ����������������2.16 gʱ��������Һ��pHΪ_________����������Һ����仯����
��3����ҵ�ϣ���Na2SO3��Һ��Ϊ����Һ�����������е�SO2������SO2�����У���ҺpH��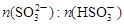 ��ϵ���±���
��ϵ���±���
|
|
91��9 |
1��1 |
9��91 |
|
pH��25�棩 |
8.2 |
7.2 |
6.2 |
�����ϱ��жϣ�NaHSO3��Һ��________�ԣ���ƽ��ԭ�����ͣ�__________________��
�ڵ���Һ������ʱ����Һ������Ũ�ȵĴ�С��ϵΪ_____________________________��
��1��CaSO4��s��+CO32-��aq��=CaCO3��s��+SO42-��aq��
2S2-+O2+2H2O=S��+4OH-
��2��b��a Br3-+2e-=3Br‑ S42- + 2e-=2S22- 1
��3������
��HSO3-��Һ�д�����������ƽ��HSO3-+ H2O H2SO3+OH-��HSO3-
H2SO3+OH-��HSO3- SO32-+H+�������Ե���Ϊ��������ҺΪ���ԡ�
SO32-+H+�������Ե���Ϊ��������ҺΪ���ԡ�
�� C(Na+)��C(HSO3-)��C(SO32-)��C(OH-)=C(H+)
��������
�����������1���÷�ӦΪ������ת����CaSO4����ˮ�����ӷ���ʽ��Ҫд��ѧʽ��
CaSO4��s��+CO32-��aq��=CaCO3��s��+SO42-��aq������д״̬Ҳ���ԣ�2S2-+O2+2H2O=S��+4OH-
(2)�����ܷ�Ӧ����ʽ���ŵ�ʱ�Ҳ�ĵ���ʴ�����Na2S2��ΪNa2S4��SԪ�ػ��ϼ۽��͵õ����ӣ��ô���Ϊԭ��ص�������Na+��ü��ƶ���a��������NaBr3�õ����ӱ�ΪNaBr����ⷴӦʽΪBr3-+2e-=3Br‑�����ʱb��������Na2S4�õ����ӱ�ΪNa2S2���缫��ӦʽΪS42- + 2e-=2S22-��
����õ������ʵ���Ϊn(Ag)=2.16��108=0.02mol n(e-)=0.02mol
����Һ��OH-�ŵ磬n(H+)=n(OH-)=n(e-)=0.02mol��c(H+)=0.02��0.2=0.1mol/L pH=1
(3)�ɱ��е��������ݿ�֪����Һ��HSO3-����ʱ����Һ�����ԣ�����SO32-��HSO3-ˮ��ʼ��ԣ���ֻ����HSO3-����Һ���Ե���Ϊ����Һ�����ԣ���HSO3-��Һ�д�����������ƽ��HSO3-+ H2O H2SO3+OH-��HSO3-
H2SO3+OH-��HSO3- SO32-+H+�������Ե���Ϊ��������ҺΪ���ԡ�
SO32-+H+�������Ե���Ϊ��������ҺΪ���ԡ�
����Һ��1��1��ϳʼ��ԣ�������������HSO3-��Һ����ת��Ϊ���ԣ�NaHSO3������Na2SO3������
C(Na+)��C(HSO3-)��C(SO32-)��C(OH-)=C(H+)
���㣺���黯ѧ��Ӧԭ���е绯ѧ����Һ������Ũ�ȵıȽϡ�������ת�����й����⡣

 ��2011?ɽ�������С������г��漰�ơ����仯���
��2011?ɽ�������С������г��漰�ơ����仯��� S��Na2
S��Na2 ,�����ĵ缫��ӦʽΪ ��M����Na2O��Al2O3�Ƶã������������� ����Ǧ������ȣ���������ͬ�����ĸ�����������ʱ�������ص����۷ŵ�����Ǧ���ص�
����
,�����ĵ缫��ӦʽΪ ��M����Na2O��Al2O3�Ƶã������������� ����Ǧ������ȣ���������ͬ�����ĸ�����������ʱ�������ص����۷ŵ�����Ǧ���ص�
����
 ��Һ������Ũ���ɴ�С��˳��Ϊ �������Һ�м�����������
��Һ������Ũ���ɴ�С��˳��Ϊ �������Һ�м����������� ����ҺPh ���������С�����䡱����
����ҺPh ���������С�����䡱����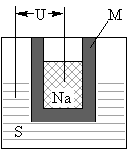 ��1��ʵ���ҿ�����ˮ�Ҵ��������������Ľ����ƣ���ѧ��Ӧ����ʽΪ___________________________________��Ҫ��ϴ�������Թܱ��ϵ����õ��Լ���________��
��1��ʵ���ҿ�����ˮ�Ҵ��������������Ľ����ƣ���ѧ��Ӧ����ʽΪ___________________________________��Ҫ��ϴ�������Թܱ��ϵ����õ��Լ���________��