摘要:(1)增大气体与溶液的接触面积.有利于SO2与碘水充分反应 (2)酸性高锰酸钾溶液 (3)偏低 (4)H2SO4+Ba(OH)2===BaSO4↓+2H2O (5)向漏斗里注入蒸馏水.使水面没过沉淀物.待水流尽后.重复操作2-3次 (6)或% (7)不合理.亚硫酸钡容易被部分氧化为硫酸钡
网址:http://m.1010jiajiao.com/timu3_id_85893[举报]
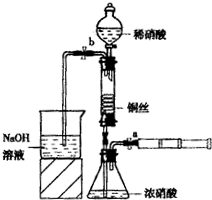 (2011?朝阳区二模)某同学利用下面装置实现铜与浓、稀硝酸反应,过程如下:
(2011?朝阳区二模)某同学利用下面装置实现铜与浓、稀硝酸反应,过程如下:Ⅰ、取一段铜丝,用稀硫酸除去铜锈〔主要成分是 Cu2(OH)2CO3〕
Ⅱ、将洗涤后的铜丝做成匝数很多的螺旋状
Ⅲ、按如图所示连接仪器、检查气密性、装入化学试剂
(1)过程Ⅰ发生反应的离子方程式是
Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
;(2)过程Ⅱ将铜丝做成螺旋状的目的是
增大铜丝与酸的接触面积,提高化学反应速率
增大铜丝与酸的接触面积,提高化学反应速率
;(3)过程Ⅲ的后续操作如下:
①为使浓硝酸与铜丝接触,操作是
打开止水夹a和b,从注射器中推入空气
打开止水夹a和b,从注射器中推入空气
.当红棕色气体较多时,轻抽注射器使反应停止,关闭a,取下注射器.生成红棕色气体的化学方程式是Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
.②控制b和分液漏斗活塞,玻璃管充满稀硝酸时,关闭b打开a,可见无色气体.稀硝酸充满玻璃管的实验目的是
将玻璃管中的NO2排出
将玻璃管中的NO2排出
.(4)将3支盛满红棕色气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致.结果如下表所示:
| 实验编号 | 水温/0C | 液面上升高度 | ||
| 1 | 25 | 超过试管
| ||
| 2 | 50 | 不足试管
| ||
| 3 | 0 | 液面上升超过实验1 |
温度越低,进入试管中的溶液体积越多
温度越低,进入试管中的溶液体积越多
;②查阅资料:
a.NO2与水反应的实际过程为:2NO2+H2O═HNO2+HNO3 3HNO2═HNO3+2NO↑+H2O
b.HNO2不稳定.
产生上述现象的原因是
温度低,HNO2分解量减少,分解产生的NO气体量减少,且生成的NO所占体积小,所以进入试管中的溶液体积增大
温度低,HNO2分解量减少,分解产生的NO气体量减少,且生成的NO所占体积小,所以进入试管中的溶液体积增大
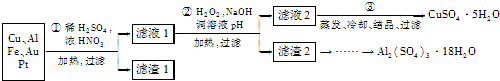
.(2013?无锡一模)信息时代产生的大量电子垃圾对环境构成了极大的威胁.某化学兴趣小组将一批废弃的线路板简单处理后,得到主要含Cu、Al及少量Fe、Au、Pt等金属的混合物,设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)第①步操作前需将金属混合物进行粉碎,其目的是
(2)某学生认为用H2O2代替浓HNO3更好,理由是
请写出Cu溶于H2O2与稀硫酸混合溶液的离子方程式:
(3)第②步中应将溶液pH调至
(4)由滤渣2制取Al2(SO4)3?18H2O,探究小组设计了两种方案:
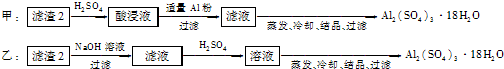
你认为
(5)为了测定硫酸铜晶体的纯度,某同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.100 0mol?L-1Na2S2O3标准溶液滴定至终点,共消耗14.00mL Na2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2S2O
+I2═2I-+S4O
①样品中硫酸铜晶体的质量分数为
②另一位同学提出通过测定样品中硫酸根离子的量也可求得硫酸铜晶体的纯度,其他同学认为此方案不可行,理由是
查看习题详情和答案>>

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 5.8 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 8.8 | 3.2 | 5.2 | 6.7 |
(1)第①步操作前需将金属混合物进行粉碎,其目的是
增大金属和酸的接触面积,加快反应速率
增大金属和酸的接触面积,加快反应速率
.(2)某学生认为用H2O2代替浓HNO3更好,理由是
不产生对环境有污染的气体
不产生对环境有污染的气体
;请写出Cu溶于H2O2与稀硫酸混合溶液的离子方程式:
Cu+H2O2+2H+═Cu2++2H2O
Cu+H2O2+2H+═Cu2++2H2O
.(3)第②步中应将溶液pH调至
5.2~5.4
5.2~5.4
.(4)由滤渣2制取Al2(SO4)3?18H2O,探究小组设计了两种方案:

你认为
甲
甲
种方案为最佳方案,理由是甲得到产品纯度高
甲得到产品纯度高
、原子利用率高
原子利用率高
.(5)为了测定硫酸铜晶体的纯度,某同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.100 0mol?L-1Na2S2O3标准溶液滴定至终点,共消耗14.00mL Na2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-═2CuI(白色)↓+I2S2O
2- 3 |
2- 6 |
①样品中硫酸铜晶体的质量分数为
87.5%
87.5%
.②另一位同学提出通过测定样品中硫酸根离子的量也可求得硫酸铜晶体的纯度,其他同学认为此方案不可行,理由是
样品中含有Na2SO4等杂质
样品中含有Na2SO4等杂质
.(2010?丰台区一模)(1)环境专家认为可以用金属铝将水体中的NO3-转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH-、Al(OH)3、NO3-、N2,请将各粒子分别填入以下空格内(不用配平).该反应过程中,被氧化与被还原的元素的物质的量之比为
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3.电池正极的电极反应式为
(3)已知:4Al(s)+3O2(g)=2Al2O3(g)△H=-2834.9kJ/mol
Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=234.1kJ/mol
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:则反应过程中产生氢气的总体积为

查看习题详情和答案>>
5:3
5:3
.(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=4Al(OH)3.电池正极的电极反应式为
2H2O+O2+4e-=4OH-
2H2O+O2+4e-=4OH-
;正极材料采用了铂网,利用铂网为正极的优点是铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积
铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积
.(3)已知:4Al(s)+3O2(g)=2Al2O3(g)△H=-2834.9kJ/mol
Fe2O3(s)+
| 3 |
| 2 |
| 3 |
| 2 |
C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式
2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)△H=-593.1kJ/mol
2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s)△H=-593.1kJ/mol
.(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:则反应过程中产生氢气的总体积为
2.016
2.016
L(标准状况).
为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如下图的实验装置.实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶I中溶液吸收CO2后的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空.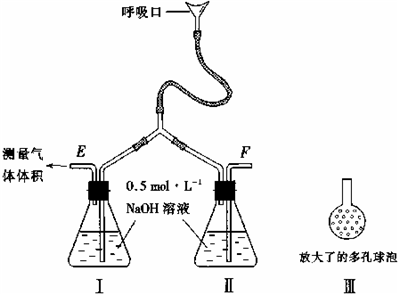
(1)图中瓶II的作用是
(2)对实验装置尚有如下A、B、C、D四种建议,你认为合理的是
A. 在E处增加CaCl2干燥管
B.在下处增加CaCl2燥管
C.在E和F两处增加CaCl2干燥管
D.不必增加干燥管
(3〕将插入溶液的管子丁端改成具有多孔的球泡(图中的皿),有利于提高实验的准确度,其理由是
(4〕实验时先缓缓吸气,再缓缓呼气,反复若干次,得如下数据:瓶I溶液增重ag,收集到的气体体积(标准状况)为bL,该呼出气体中CO2的体积分数是(列出算式)
.
(5〕实验中若猛吸猛呼,会造成不安全后果,猛吸时会
查看习题详情和答案>>

(1)图中瓶II的作用是
除去吸人空气中的CO2
除去吸人空气中的CO2
.(2)对实验装置尚有如下A、B、C、D四种建议,你认为合理的是
D
D
.(填代号〕A. 在E处增加CaCl2干燥管
B.在下处增加CaCl2燥管
C.在E和F两处增加CaCl2干燥管
D.不必增加干燥管
(3〕将插入溶液的管子丁端改成具有多孔的球泡(图中的皿),有利于提高实验的准确度,其理由是
可增大气体与溶液的接触面积,使气体中的CO2被充分吸收
可增大气体与溶液的接触面积,使气体中的CO2被充分吸收
.(4〕实验时先缓缓吸气,再缓缓呼气,反复若干次,得如下数据:瓶I溶液增重ag,收集到的气体体积(标准状况)为bL,该呼出气体中CO2的体积分数是(列出算式)
| ||
bL+
|
| ||
bL+
|
(5〕实验中若猛吸猛呼,会造成不安全后果,猛吸时会
把瓶1中的NaOH溶液吸人口中
把瓶1中的NaOH溶液吸人口中
.猛呼时会把瓶II中的NaOH溶液吹出瓶外
把瓶II中的NaOH溶液吹出瓶外
.为清楚地看到无色NO遇空气变为红棕色(或浅棕色)的过程.某化学兴趣小组的甲、乙两位同学分别设计如下两个实验:
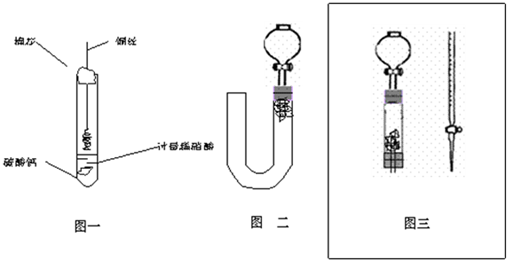
(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象.第①步放入大理石的作用是:
(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞,NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色.但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会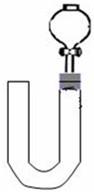
②反应开始后,因为随着NO的体积增加,
(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来.为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达
(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考.已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2═NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO═2NaNO2+H2,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释:
查看习题详情和答案>>

(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象.第①步放入大理石的作用是:
除去装置内的空气,防止生成的NO被氧化而影响实验效果
除去装置内的空气,防止生成的NO被氧化而影响实验效果
.(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞,NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色.但按他的方法实际操作的丙同学发现此法至少存在两个问题:
①当酸液加到浸没分液漏斗下端管口以后,会
因如图所示的铜丝所在空间中被封闭一段空气
因如图所示的铜丝所在空间中被封闭一段空气
而使后面的实验无法观察到预期现象.
②反应开始后,因为随着NO的体积增加,
产生的NO排开酸液而与大部分铜丝脱离接触
产生的NO排开酸液而与大部分铜丝脱离接触
影响铜丝与硝酸的继续反应.(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来.为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达
分液漏斗最大量程刻度处
分液漏斗最大量程刻度处
,设定有条件精确称量,还需要的数据是铜丝反应前后的质量
铜丝反应前后的质量
.(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考.已知氢氧化钠溶液可以吸收NO2,方程式为2NaOH+2NO2═NaNO2+NaNO3+H2O,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为2NaOH+NO2+NO═2NaNO2+H2,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释: