题目内容
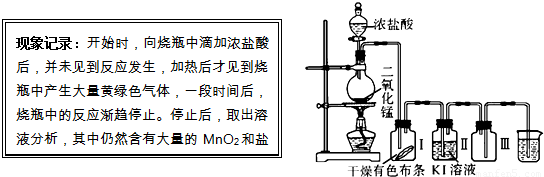
A:某同学用下列装置制取氯气并进行氯气的性质实验,请根据描述的实验现象回答下面的几个问题.
(1)据此现象,你认为在书写MnO2和盐酸反应的化学方程式时,一定要注意
(2)查阅资料,干燥的氯气没有漂白作用,但实验时发现广口瓶Ⅰ中干燥的有色布条褪色,其原因是
(3)烧杯中物质为氢氧化钠溶液,其作用是
(4)在探究氯水漂白原因时,为了确证是HClO起了漂白作用,你认为还应增加的实验是:检验

(1)据此现象,你认为在书写MnO2和盐酸反应的化学方程式时,一定要注意
加热
加热
符号的书写和盐酸浓度
浓度
的标注.(2)查阅资料,干燥的氯气没有漂白作用,但实验时发现广口瓶Ⅰ中干燥的有色布条褪色,其原因是
产生的氯气中混有水蒸气
产生的氯气中混有水蒸气
;实验结束后,要从广口瓶Ⅱ中分离得到固态I2,应先进行的操作是萃取
萃取
,然后再作进一步的后续处理.(3)烧杯中物质为氢氧化钠溶液,其作用是
尾气处理,防止环境污染
尾气处理,防止环境污染
.(4)在探究氯水漂白原因时,为了确证是HClO起了漂白作用,你认为还应增加的实验是:检验
盐酸
盐酸
(填物质名称)能否使红色布条褪色.分析:(1)根据MnO2和盐酸反应的条件进行解答;
(2)根据杂质的成分及性质分析;根据碘的性质进行解答;
(3)根据氯气的性质分析;
(4)根据氯气和水反应的产物是盐酸和次氯酸,证明二者谁有漂白性即可;
(2)根据杂质的成分及性质分析;根据碘的性质进行解答;
(3)根据氯气的性质分析;
(4)根据氯气和水反应的产物是盐酸和次氯酸,证明二者谁有漂白性即可;
解答:解:(1)MnO2和盐酸反应需在加热的条件下反应,且稀盐酸与MnO2不反应,所以书写MnO2和盐酸反应的化学方程式时,一定要注意加热符号的书写和盐酸浓度的标注,反应方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:加热;浓度;
(2)浓盐酸中的水在加热条件下变成水蒸气,所以氯气中混有水蒸气;氯气有氧化性,能置换出碘化钾中的碘,广口瓶Ⅱ中Cl2+2KI=2KCl+I2,从氯化钾溶液中获取碘需用萃取的方法,
故答案为:产生的氯气中混有水蒸气;萃取;
(3)氯气有毒,污染环境,所以不能直接排空;氯气能和氢氧化钠反应2NaOH+Cl2 =NaCl+NaClO+H2O,所以可用氢氧化钠溶液吸收多余的氯气,
故答案为:尾气处理,防止环境污染;
(4)氯气和水反应的产物是盐酸和次氯酸,要证明谁有漂白性,得做两个实验:证明盐酸是否有漂白性和证明次氯酸是否有漂白性的实验,
故答案为:盐酸;
| ||
故答案为:加热;浓度;
(2)浓盐酸中的水在加热条件下变成水蒸气,所以氯气中混有水蒸气;氯气有氧化性,能置换出碘化钾中的碘,广口瓶Ⅱ中Cl2+2KI=2KCl+I2,从氯化钾溶液中获取碘需用萃取的方法,
故答案为:产生的氯气中混有水蒸气;萃取;
(3)氯气有毒,污染环境,所以不能直接排空;氯气能和氢氧化钠反应2NaOH+Cl2 =NaCl+NaClO+H2O,所以可用氢氧化钠溶液吸收多余的氯气,
故答案为:尾气处理,防止环境污染;
(4)氯气和水反应的产物是盐酸和次氯酸,要证明谁有漂白性,得做两个实验:证明盐酸是否有漂白性和证明次氯酸是否有漂白性的实验,
故答案为:盐酸;
点评:本题考查了制取氯气实验相关内容的探究,掌握氯气的化学性质,熟悉实验室制备氯气的步骤是解答的关键,题目难度中等.

练习册系列答案
相关题目