摘要:3.将等体积.等pH的NaOH溶液和氨水.分别全部加入到甲.乙烧杯中.下列说法正确的是( ) A.甲中沉淀一定比乙多 B.乙中沉淀一定比甲多 C.甲中沉淀可能比乙多 D.甲和乙中沉淀可能一样多 解析:NaOH溶液可以溶解Al(OH)3.而NH3·H2O不能溶解Al(OH)3.等体积.等pH的NaOH溶液和氨水.显然n(NH3·H2O)>n.当n≤3n(Al3+)时.甲和乙中沉淀一样多,当n>3n(Al3+)时.甲中沉淀比乙少,不可能出现甲中沉淀比乙多的情况. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_85411[举报]
在下列叙述中,不能说明盐酸是强酸,醋酸是弱酸的是
A.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,醋酸所加的水量多
B.氯化钠溶液呈中性,醋酸钠溶液呈碱性
C.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
D.等体积、相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸pH变大
查看习题详情和答案>>
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是
A.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,醋酸所加的水量少
B.盐酸可与醋酸钠溶液反应生成醋酸
C.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
D.等体积、相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸pH变大
查看习题详情和答案>>A、B、C、D、E均为短周期元素,且原子序数逐渐增大.A、D最外层电子数相等且能形成离子化合物,A与B的质子数之和等于C的质子数,A+与 C2-的核外电子数之和等于D+离子的核外电子数,B 原子与 D+离子的核外电子数之和等于 E 原子的核外电子数.
(1)B的元素符号为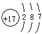
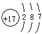 ;由A、C、E三种元素组成的化合物具有漂白性,其电子式为
;由A、C、E三种元素组成的化合物具有漂白性,其电子式为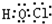
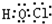 .
.
(2)将少量的D2C2投入到Na2S溶液中,产生浑浊现象,则反应的离子方程式为
(3)A、B、C三种元素可组成多种化合物,请写出两种水溶液呈酸性的化合物,其中甲物质促进水的电离
(4)A与B化合形成10电子化合物丙,A与E化合形成18电子化合物丁;常温下,pH=11的丙溶液与pH=3的丁溶液等体积混合后溶液的pH
(5)A2与C2可构成燃烧电池,若电解质溶液为KOH溶液,该电池的负极反应为
查看习题详情和答案>>
(1)B的元素符号为
N
N
,E的原子结构示意图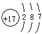
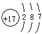
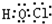
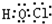
(2)将少量的D2C2投入到Na2S溶液中,产生浑浊现象,则反应的离子方程式为
2H2O+S2-+Na2O2═4OH-+S↓+2Na+
2H2O+S2-+Na2O2═4OH-+S↓+2Na+
.(3)A、B、C三种元素可组成多种化合物,请写出两种水溶液呈酸性的化合物,其中甲物质促进水的电离
NH4NO3
NH4NO3
,物质乙抑制水的电离HNO3
HNO3
;室温下,若两溶液的pH都为4,则两溶液中水电离的氢离子浓度比为:甲:乙=106
106
(4)A与B化合形成10电子化合物丙,A与E化合形成18电子化合物丁;常温下,pH=11的丙溶液与pH=3的丁溶液等体积混合后溶液的pH
>
>
7(填“>”“<”“=”),溶液中离子浓度由大到小的顺序为C(NH4+)>C(Cl-)>C(OH-)>C(H+)
C(NH4+)>C(Cl-)>C(OH-)>C(H+)
.(5)A2与C2可构成燃烧电池,若电解质溶液为KOH溶液,该电池的负极反应为
H2+2e-+2OH-=2H2O
H2+2e-+2OH-=2H2O
. (2011?南平二模)火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(2011?南平二模)火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.(1)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)
△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)
△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
.(2)脱碳.将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H3
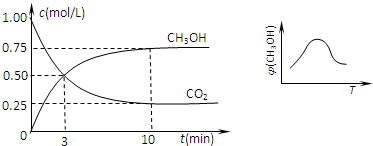
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则φ(CH3OH)T上述CO2转化为甲醇的反应的△H3
<
<
0(填“>”、“<”或“=”).②在一恒温恒容密闭容器中充入1mol CO2和3mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如下图所示.下列说法正确的是
CE
CE
(填字母代号).A.第10min后,向该容器中再充入1mol CO2和3mol H2,则再次达到平衡时c(CH3OH)=1.5mol?L-1
B.0~10min内,氢气的平均反应速率为0.075mol/(L?min)
C.达到平衡时,氢气的转化率为0.75
D.该温度下,反应的平衡常数的值为3/16
E.升高温度将使n(CH3OH)/n(CO2)减小
③甲醇燃料电池结构如下图所示.其工作时正极的电极反应式可表示为
O2+4e-+4H+=2H2O
O2+4e-+4H+=2H2O
.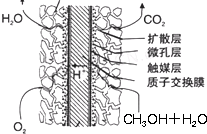
多孔碳电极
(3)脱硫.某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为
12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3
12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3
.(4)硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为:
NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+) NH3?H2O+H+
NH3?H2O+H+<
<
c(NO3-)+c(OH-)(填写“>”“=”或“<”)A、B、C、D分别由下面的一种阳离子和一种阴离子结合而成(阳离子:NH4+Na+、H+;阴离子:Cl-、OH-,
SO32-.可重复选择),它们均能抑制水的电离.常温下将一定浓度的各溶液从1mL稀释到1000ml,pH变化如图1所示.请回答:
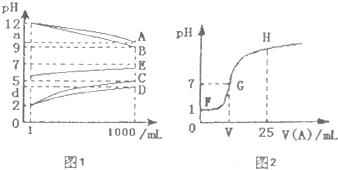
(1)根据图1的pH变化关系写出化学式:A ,C .
(2)等体积、等物质的量浓度的B溶液与D溶液反应生成E,E溶液显酸性,其原因是
(3)图2是室温时向25mL某浓度的C溶液中逐渐滴加0.25mol/LA溶液时pH的变化曲线.
G点呈中性,此时,V(A) 1OmL (填“=”、“>”或“<”).当A、C恰好中和时,
V(A)应在 之间(填“FG”或“GH”).
查看习题详情和答案>>
SO32-.可重复选择),它们均能抑制水的电离.常温下将一定浓度的各溶液从1mL稀释到1000ml,pH变化如图1所示.请回答:

(1)根据图1的pH变化关系写出化学式:A
(2)等体积、等物质的量浓度的B溶液与D溶液反应生成E,E溶液显酸性,其原因是
(3)图2是室温时向25mL某浓度的C溶液中逐渐滴加0.25mol/LA溶液时pH的变化曲线.
G点呈中性,此时,V(A)
V(A)应在