题目内容
A、B、C、D分别由下面的一种阳离子和一种阴离子结合而成(阳离子:NH4+Na+、H+;阴离子:Cl-、OH-,
SO32-.可重复选择),它们均能抑制水的电离.常温下将一定浓度的各溶液从1mL稀释到1000ml,pH变化如图1所示.请回答:
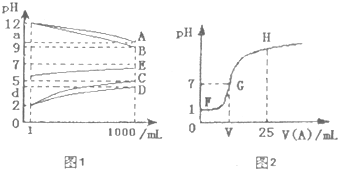
(1)根据图1的pH变化关系写出化学式:A ,C .
(2)等体积、等物质的量浓度的B溶液与D溶液反应生成E,E溶液显酸性,其原因是
(3)图2是室温时向25mL某浓度的C溶液中逐渐滴加0.25mol/LA溶液时pH的变化曲线.
G点呈中性,此时,V(A) 1OmL (填“=”、“>”或“<”).当A、C恰好中和时,
V(A)应在 之间(填“FG”或“GH”).
SO32-.可重复选择),它们均能抑制水的电离.常温下将一定浓度的各溶液从1mL稀释到1000ml,pH变化如图1所示.请回答:

(1)根据图1的pH变化关系写出化学式:A
(2)等体积、等物质的量浓度的B溶液与D溶液反应生成E,E溶液显酸性,其原因是
(3)图2是室温时向25mL某浓度的C溶液中逐渐滴加0.25mol/LA溶液时pH的变化曲线.
G点呈中性,此时,V(A)
V(A)应在
分析:酸或碱抑制水电离,这四种物质都抑制水电离,所以这四种物质为酸或碱,为NaOH、NH3.H2O、HCl、H2SO3,加水稀释促进弱电解质电离,稀释相同的倍数,弱电解质的PH变化较较小,强电解质的pH变化较大,根据图象1知,A、B未稀释时,溶液pH>7,则为碱,稀释相同的倍数时,A的pH变化小于B,则B是NaOH,A是NH3.H2O;
C、D溶液pH<7,则C和D是酸,稀释相同的倍数时,C的pH变化大于D,所以C是HCl,D是H2SO3,结合物质的性质分析解答.
C、D溶液pH<7,则C和D是酸,稀释相同的倍数时,C的pH变化大于D,所以C是HCl,D是H2SO3,结合物质的性质分析解答.
解答:解:酸或碱抑制水电离,这四种物质都抑制水电离,所以这四种物质为酸或碱,为NaOH、NH3.H2O、HCl、H2SO3,加水稀释促进弱电解质电离,稀释相同的倍数,弱电解质的PH变化较较小,强电解质的pH变化较大,根据图象1知,A、B未稀释时,溶液pH>7,则为碱,稀释相同的倍数时,A的pH变化小于B,则B是NaOH,A是NH3.H2O;
C、D溶液pH<7,则C和D是酸,稀释相同的倍数时,C的pH变化大于D,所以C是HCl,D是H2SO3,
(1)通过以上分析知,A是NH3.H2O,C是HCl,
故答案为:NH3.H2O;HCl;
(2)B是NaOH,D是H2SO3,等物质的量的二者恰好完全反应生成NaHSO3,溶液呈酸性,说明HSO3-的电离程度大于其水解程度而使其溶液呈酸性,
故答案为:HSO3-的电离程度大于其水解程度而使其溶液呈酸性;
(3)C是HCl,未加氨水时,盐酸溶液的pH=1,则c(HCl)=0.1mol/L,G点溶液呈中性,氯化铵是强酸弱碱盐,铵根离子易水解而使其溶液呈酸性,要使氨水和盐酸溶液呈中性,则n(NH3.H2O)>n(HCl),所以V(A)>1OmL,当氨水和盐酸恰好反应时,溶液中的溶质是氯化铵,溶液呈酸性,所以V(A)=10mL,所以应在FG之间,
故答案为:>;FG.
C、D溶液pH<7,则C和D是酸,稀释相同的倍数时,C的pH变化大于D,所以C是HCl,D是H2SO3,
(1)通过以上分析知,A是NH3.H2O,C是HCl,
故答案为:NH3.H2O;HCl;
(2)B是NaOH,D是H2SO3,等物质的量的二者恰好完全反应生成NaHSO3,溶液呈酸性,说明HSO3-的电离程度大于其水解程度而使其溶液呈酸性,
故答案为:HSO3-的电离程度大于其水解程度而使其溶液呈酸性;
(3)C是HCl,未加氨水时,盐酸溶液的pH=1,则c(HCl)=0.1mol/L,G点溶液呈中性,氯化铵是强酸弱碱盐,铵根离子易水解而使其溶液呈酸性,要使氨水和盐酸溶液呈中性,则n(NH3.H2O)>n(HCl),所以V(A)>1OmL,当氨水和盐酸恰好反应时,溶液中的溶质是氯化铵,溶液呈酸性,所以V(A)=10mL,所以应在FG之间,
故答案为:>;FG.
点评:本题考查了弱电解质的电离及酸碱混合溶液定性判断,明确弱电解质稀释特点是解本题关键,再结合物质的性质来分析解答,难度中等.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
 回答下列各小题:
回答下列各小题:
 (1)服用含碘化钾的碘药片可抗核辐射.将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色,试回答下列问题:
(1)服用含碘化钾的碘药片可抗核辐射.将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色,试回答下列问题: