摘要:已知Ca(OH)2的溶解度随温度的升高而降低。将40℃的饱和澄清石灰水冷却至10℃,或保持40℃向其中加入少量CaO,两种情况下均保持不变的是( ) A.溶液中Ca2+的数目 B.溶剂的质量 C.溶液中溶质的物质的量浓度 D.溶质的质量 解析:将40℃的饱和澄清石灰水冷却至10℃时,此时溶液是不饱和溶液,溶液中溶质质量、溶剂质量均不变,所以溶液中Ca(OH)2的物质的量浓度不变。保持40℃向其中加入少量CaO,CaO与H2O反应导致溶剂质量减少,有部分Ca(OH)2晶体析出,但溶液仍是40℃时的饱和溶液,所以Ca(OH)2的物质的量浓度不变,综合上述知选项C正确。 答案:C
网址:http://m.1010jiajiao.com/timu3_id_85340[举报]
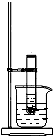 如图所示,将Ba(OH)2?8H2O和氯化铵晶体混合后放入试管中,迅速将该试管放入盛有饱和硝酸钾的烧杯中,并用玻璃棒不断搅拌试管中的固体混合物.(已知硝酸钾的溶解度随温度的升高而升高)实验二:将Ba(OH)2?8H2O和氯化铵晶体混合后放入烧杯中,并将烧杯放在事先滴有少量水的玻璃片上.试回答下列问题:
如图所示,将Ba(OH)2?8H2O和氯化铵晶体混合后放入试管中,迅速将该试管放入盛有饱和硝酸钾的烧杯中,并用玻璃棒不断搅拌试管中的固体混合物.(已知硝酸钾的溶解度随温度的升高而升高)实验二:将Ba(OH)2?8H2O和氯化铵晶体混合后放入烧杯中,并将烧杯放在事先滴有少量水的玻璃片上.试回答下列问题:(1)两个实验中共同观察到的现象是
反应混合物成糊状,有刺激性气味气体产生
反应混合物成糊状,有刺激性气味气体产生
实验一中还有有硝酸钾晶体析出
有硝酸钾晶体析出
现象,实验二中还有玻片与烧杯之间结冰黏在一起
玻片与烧杯之间结冰黏在一起
现象.(2)产生上述现象的原因是
反应是吸热反应
反应是吸热反应
(3)写出上述反应的化学方程式:
Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O
Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O
.从实验此反应可知生成物的总能量大于
大于
(填大于、等于或小于)反应物的总能量.(4)实验二中若没有看到预期的现象,其原因可能是
玻璃片滴的水过多或搅拌不充分
玻璃片滴的水过多或搅拌不充分
(答一种即可)(5)实验一中烧杯中溶液的K+的物质的量浓度将
减小
减小
(填增大、不变或减小)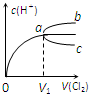 一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如下图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )
一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如下图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( ) 一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )
一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )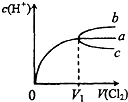 (2010?和平区一模)一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )
(2010?和平区一模)一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( ) 室温下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和(假设Cl2在水中只发生如下反应:Cl2+H2O=HCl+HClO,溶液中c(H+)变化入下图中的曲线a.已知Cl2的溶解度随温度的升高而迅速降低,下列叙述中正确的( )
室温下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和(假设Cl2在水中只发生如下反应:Cl2+H2O=HCl+HClO,溶液中c(H+)变化入下图中的曲线a.已知Cl2的溶解度随温度的升高而迅速降低,下列叙述中正确的( )