题目内容
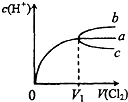 (2010?和平区一模)一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )
(2010?和平区一模)一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )分析:A.将饱和氯水升高温度,Cl2的溶解度随温度升高而迅速降低,溶液中c(H+)应减小;
B.根据电荷守恒判断;
C.降低温度抑制次氯酸电离;
D.溶液PH=7时,次氯酸过量,溶液中c(Cl-)>c(ClO-).
B.根据电荷守恒判断;
C.降低温度抑制次氯酸电离;
D.溶液PH=7时,次氯酸过量,溶液中c(Cl-)>c(ClO-).
解答:解:A.将饱和氯水升高温度,Cl2的溶解度随温度升高而迅速降低,溶液中c(H+)应减小,溶液中c(H+)变化如曲线c,故A错误;
B.将饱和氯水升高温度,Cl2的溶解度随温度升高而迅速降低,溶液中c(H+)应减小,溶液中c(H+)变化如曲线c,故B正确;
C.降低温度抑制次氯酸电离,则溶液中c(H+)减小,故C错误;
D.溶液PH=7时,次氯酸过量,溶液中存在:c(Cl-)=c(HClO)+c(ClO-),c(Cl-)>c(ClO-),故D错误;
故选B.
B.将饱和氯水升高温度,Cl2的溶解度随温度升高而迅速降低,溶液中c(H+)应减小,溶液中c(H+)变化如曲线c,故B正确;
C.降低温度抑制次氯酸电离,则溶液中c(H+)减小,故C错误;
D.溶液PH=7时,次氯酸过量,溶液中存在:c(Cl-)=c(HClO)+c(ClO-),c(Cl-)>c(ClO-),故D错误;
故选B.
点评:本题考查弱电解质的电离平衡,涉及离子浓度大小比较,做题中注意外界条件对电离平衡的影响,利用电荷守恒、质量守恒解答此类题目.

练习册系列答案
相关题目
 (2010?和平区一模)阿斯巴甜(Aspartame)具有清爽的甜味,甜度约为蔗糖的200倍.有关说法不正确的是( )
(2010?和平区一模)阿斯巴甜(Aspartame)具有清爽的甜味,甜度约为蔗糖的200倍.有关说法不正确的是( )