题目内容
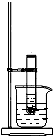 如图所示,将Ba(OH)2?8H2O和氯化铵晶体混合后放入试管中,迅速将该试管放入盛有饱和硝酸钾的烧杯中,并用玻璃棒不断搅拌试管中的固体混合物.(已知硝酸钾的溶解度随温度的升高而升高)实验二:将Ba(OH)2?8H2O和氯化铵晶体混合后放入烧杯中,并将烧杯放在事先滴有少量水的玻璃片上.试回答下列问题:
如图所示,将Ba(OH)2?8H2O和氯化铵晶体混合后放入试管中,迅速将该试管放入盛有饱和硝酸钾的烧杯中,并用玻璃棒不断搅拌试管中的固体混合物.(已知硝酸钾的溶解度随温度的升高而升高)实验二:将Ba(OH)2?8H2O和氯化铵晶体混合后放入烧杯中,并将烧杯放在事先滴有少量水的玻璃片上.试回答下列问题:(1)两个实验中共同观察到的现象是
反应混合物成糊状,有刺激性气味气体产生
反应混合物成糊状,有刺激性气味气体产生
实验一中还有有硝酸钾晶体析出
有硝酸钾晶体析出
现象,实验二中还有玻片与烧杯之间结冰黏在一起
玻片与烧杯之间结冰黏在一起
现象.(2)产生上述现象的原因是
反应是吸热反应
反应是吸热反应
(3)写出上述反应的化学方程式:
Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O
Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O
.从实验此反应可知生成物的总能量大于
大于
(填大于、等于或小于)反应物的总能量.(4)实验二中若没有看到预期的现象,其原因可能是
玻璃片滴的水过多或搅拌不充分
玻璃片滴的水过多或搅拌不充分
(答一种即可)(5)实验一中烧杯中溶液的K+的物质的量浓度将
减小
减小
(填增大、不变或减小)分析:(1)反应有水生成,晶体变成糊状,同时反应生成了氨气;实验一由于温度降低,硝酸钾溶解度减小,有晶体析出;实验二出现结冰现象;
(2)根据反应吸热、放热进行分析;
(3)氢氧化钡晶体与氯化铵反应生成氯化钡、氨气和水;根据反应是吸热反应分析;
(4)实验二中没有看到结冰的现象,说明水的温度没有降低到结冰的温度;
(5)从硝酸钾的溶解度减小分析.
(2)根据反应吸热、放热进行分析;
(3)氢氧化钡晶体与氯化铵反应生成氯化钡、氨气和水;根据反应是吸热反应分析;
(4)实验二中没有看到结冰的现象,说明水的温度没有降低到结冰的温度;
(5)从硝酸钾的溶解度减小分析.
解答:解:(1)由于该反应有水生成,晶体变成糊状,同时反应生成了有刺激性气味的氨气;实验一中由于反应吸热,硝酸钾溶液温度降低,硝酸钾溶解度减小,会有晶体析出;实验二中由于反应吸热,导致水的温度降低,出现结冰现象,
故答案为:反应混合物成糊状,有刺激性气味气体产生;有硝酸钾晶体析出;玻片与烧杯之间结冰黏在一起;
(2)氢氧化钡晶体与氯化铵晶体的反应是吸热反应,反应吸热导致温度降低,
故答案为:反应是吸热反应;
(3)氢氧化钡晶体与氯化铵晶体反应的化学方程式为:Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O;反应是吸热反应,所以反应物能量低于生成物能量,
故答案为:Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O;大于;
(4)实验二若是玻璃片滴的水过多或搅拌不充分,不会出现结冰现象,
故答案为:玻璃片滴的水过多或搅拌不充分;
(5)由于硝酸钾溶度积降低,溶液中硝酸钾的浓度将减小,
故答案为:减小.
故答案为:反应混合物成糊状,有刺激性气味气体产生;有硝酸钾晶体析出;玻片与烧杯之间结冰黏在一起;
(2)氢氧化钡晶体与氯化铵晶体的反应是吸热反应,反应吸热导致温度降低,
故答案为:反应是吸热反应;
(3)氢氧化钡晶体与氯化铵晶体反应的化学方程式为:Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O;反应是吸热反应,所以反应物能量低于生成物能量,
故答案为:Ba(OH)2?8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O;大于;
(4)实验二若是玻璃片滴的水过多或搅拌不充分,不会出现结冰现象,
故答案为:玻璃片滴的水过多或搅拌不充分;
(5)由于硝酸钾溶度积降低,溶液中硝酸钾的浓度将减小,
故答案为:减小.
点评:本题考查吸热反应的探究,题目难度不大,本题注意把握氯化铵和氢氧化钡反应的原理,注意从反应物与生成物总能量的关系分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
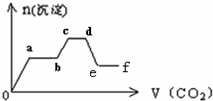 将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )
将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )| A、o-a段反应的化学方程式是:Ba(OH)2+CO2=Ba CO3↓+H2O | B、b-c段反应的离子方程式是:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32- | C、a-b段与c-d段所发生的反应相同 | D、d-e段沉淀的减少是由于碳酸钡固体的消失所致 |
 纯净物根据其组成和性质可进行如下分类.
纯净物根据其组成和性质可进行如下分类.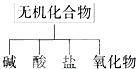 无机化合物可根据其组成和性质进行分类:
无机化合物可根据其组成和性质进行分类: