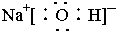题目内容
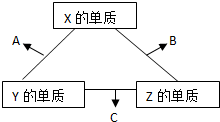
X、Y、Z三种短周期元素,X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。

请回答下列问题:
(1)X元素在周期表中的位置是第__________周期第___________族。
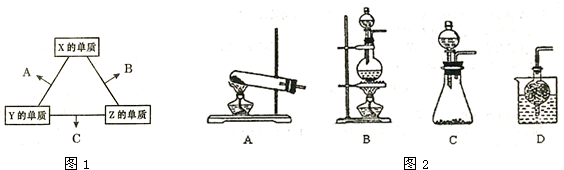
(2)下图是实验室模拟工业法合成C的简易装置。简述检验有C生成的方法_____________。

(3)在298 K时,Y(g)+3Z(g) ![]() 2C(g) ;ΔH=-92.4 kJ·mol-1,将Y、Z两种单质按物质的量比1∶3充入一密闭容器中。问:
2C(g) ;ΔH=-92.4 kJ·mol-1,将Y、Z两种单质按物质的量比1∶3充入一密闭容器中。问:
在298 K时,将10 mol Y和30 mol Z充入一密闭容器中,为何放出的热量小于924 kJ?_______________。
(4)C在一定条件下反应生成A的化学方程式是_______________。
(5)X、Y、Z三种元素可组成一种强酸D,C在适当条件下被D吸收生成一种盐E,25 ℃时,0.1 mol·L-1 E溶液中水的电离程度_______________(填“大于”“等于”或“小于”)0.1 mol·L-1 NaOH溶液中水的电离程度。若将0.1 mol·L-1 NaOH溶液和0.2 mol·L-1 E溶液等体积混合,所得溶液中离子浓度由大到小的顺序为_______________。
(1)二 ⅥA
(2)将湿润的红色石蕊试纸放在管口处,若试纸变蓝说明有氨气生成
(3)①该反应是可逆反应,10 mol Y和30 mol Z不可能完全反应,所以放出的热量小于10 mol×92.4 kJ·mol-1=924 kJ
(4)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(5)大于〔c(![]() )>c(
)>c(![]() )>c(Na+)>c(OH-)>c(H+)〕
)>c(Na+)>c(OH-)>c(H+)〕
解析:由X、Y、Z三种短周期元素其单质是无色气体,且一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10,可推知B为H2O,C为NH3,X为O,Y为N,Z为H。
(1)X元素在周期表中的位置是第二周期第ⅥA族。
(2)NH3显碱性故将湿润的红色石蕊试纸放在管口处,若试纸变蓝说明有氨气生成
(3)92.4 kJ·mol-1指1 mol Y和3 mol Z完全反应时放出的热量。10 mol Y和30 mol Z充入一密闭容器中,因反应可逆不能完全转化,放出的热量小于924 kJ
(4)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
(5)强碱抑制水的电离,强酸弱碱盐促进水的电离。若将0.1 mol·L-1 NaOH溶液和0.2 mol·L-1 E溶液等体积混合后,所得溶液为等浓度的NaNO3、NH4NO3、NH3·H2O的混合物,NH3·H2O的电离程度大于NH4NO3的水解程度,故离子浓度大小顺序为:c(![]() )>c(
)>c(![]() )>c(Na+)>c(OH-)>c(H+)
)>c(Na+)>c(OH-)>c(H+)

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案