摘要:5.接触法制硫酸工艺中.其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g) 2SO3(g).ΔH=-190 kJ/mol (1)下列描述中能说明上述反应已达平衡的是 . a.v(O2)正=2v(SO3)逆 b.容器中气体的平均分子量不随时间而变化 c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化 (2)在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2.半分钟后达到平衡.测得容器中含SO3 0.18 mol.则v(O2)= mol·L-1·min-1,若继续通入0.20 mol SO2和0.10 mol O2.则平衡 移动(填“向正反应方向 .“向逆反应方向 或“不 ).再次达到平衡后. mol<n(SO3)< mol. 解析:(1)该反应是反应前后气体物质的量不相等的反应.故密闭容器中气体的分子数保持不变.气体的物质的量不再发生变化时.表明反应已处于平衡状态. (2)v(SO3)==0.072 mol/ v(O2)=v(SO3)=0.036 mol/ 第一次平衡时:2SO2(g)+O2(g) 2SO3(g) 起始: 0.2 mol 0.10 mol 0 变化: 0.18 mol 0.09 mol 0.18 mol 平衡: 0.02 mol 0.01 mol 0.18 mol 再往容器中充入0.2 mol SO2和0.1 mol.若保持恒压.则可建立等效平衡.此时n(SO3)=0.18 mol×2=0.36 mol现保持恒温恒容.则需要将气体增压.上述平衡正向移动.n(SO3)>0.36 mol. 答案:0.036 向正反应方向 0.36 0.40 [发展等级评价]
网址:http://m.1010jiajiao.com/timu3_id_84819[举报]
根据以下事实,回答下列问题
(1)工业接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)?2SO3(g)△H=-190kJ?mol-1该热化学反应方程式的意义是
(2)在25℃、101kPa下,1g甲醇[CH3OH(l)]燃烧生成CO2和液态水时放热.22.68kJ.则表示甲醇燃烧热的热化学方程式为
(3)已知25℃、l01kPa时下列反应的热化学方程式为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
③H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol,则C(s)与H2(g)、O2(g)反应生成CH3COOH(l)在该条件下的热化学方程式为
(4)由N2和H2合成1molNH3时可放出46.2kJ的热量.从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是
查看习题详情和答案>>
(1)工业接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)?2SO3(g)△H=-190kJ?mol-1该热化学反应方程式的意义是
在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ,
在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ,
.(2)在25℃、101kPa下,1g甲醇[CH3OH(l)]燃烧生成CO2和液态水时放热.22.68kJ.则表示甲醇燃烧热的热化学方程式为
CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ?mol-1
| 3 |
| 2 |
CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ?mol-1
.| 3 |
| 2 |
(3)已知25℃、l01kPa时下列反应的热化学方程式为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
③H2(g)+
| 1 |
| 2 |
2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol
2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol
.(4)由N2和H2合成1molNH3时可放出46.2kJ的热量.从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是
391.6kJ/mol
391.6kJ/mol
.接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g);△H=-190KJ/mol
(1)该反应的平衡常数表达式是
(2)说明反应达到平衡状态是
a. V(O2)正=2V(SO3)逆 b.ひ(SO2)正?ひ(O2)逆=2:1
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
e.容器中气体的平均分子量不随时间而变化
(3)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则V(O2)=
查看习题详情和答案>>
(1)该反应的平衡常数表达式是
K=
2
| [SO3] |
| [SO2]2[O2] |
K=
2
,该反应450℃时的平衡常数| [SO3] |
| [SO2]2[O2] |
大于
大于
500℃时的平衡常数(填“大于”、“小于”或“等于”).(2)说明反应达到平衡状态是
bde
bde
.a. V(O2)正=2V(SO3)逆 b.ひ(SO2)正?ひ(O2)逆=2:1
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
e.容器中气体的平均分子量不随时间而变化
(3)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则V(O2)=
0.036
0.036
mol.L-1.min-1:若继续通入0.30mol SO2和0.15mol O2,则平衡向正反应方向
向正反应方向
移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36
0.36
mol<n(SO3)<0.50
0.50
mol.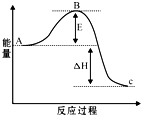 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g),该反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:
(1)E的大小对该反应的反应热有无影响?
无
无
.该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?降低
降低
(2)图中△H=
-198
-198
KJ?mol-1;(3)该反应450℃时的平衡常数
大于
大于
500℃时的平衡常数(填“大于”、“小于”或“等于”).(4)下列描述中能说明上述反应已平衡的是:
bd
bd
a.v(O2)正=2v(SO3)逆
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(5)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,若继续通入0.20mol SO2和0.10mol O2,则平衡
向正反应方向
向正反应方向
移动(填“向正反应方向”、“向逆反应方向”或“不”). 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H<0
(1)该反应450℃时的平衡常数
大于
大于
500℃时的平衡常数(填“大于”、“小于”或“等于”).(2)该化学达到平衡的标志是
b、d
b、d
.a.v(O2)正=2v( SO3)逆 b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)恒温、密闭容器体系中充入一定量SO2、O2,反应达平衡时,某物理量随体系总压强(p)的关系如图所示所示.该物理量可能是
b、d
b、d
.a.平衡体系中SO2的体积分数
b.气体的平均相对分子质量
c.混合气体的密度
d.平衡体系中SO2的转化率
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=
0.036
0.036
mol?L-1?min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡向正反应方向
向正反应方向
移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.36
0.36
mol<n(SO3)<0.40
0.40
mol.(5)压强及温度对SO2转化率的影响如表(原料气各成分的体积分数为:SO27%;O21l%;N2 82%);
| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
400℃~500℃
400℃~500℃
℃,压强0.1
0.1
MPa.