题目内容
根据以下事实,回答下列问题
(1)工业接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)?2SO3(g)△H=-190kJ?mol-1该热化学反应方程式的意义是
(2)在25℃、101kPa下,1g甲醇[CH3OH(l)]燃烧生成CO2和液态水时放热.22.68kJ.则表示甲醇燃烧热的热化学方程式为
(3)已知25℃、l01kPa时下列反应的热化学方程式为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
③H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol,则C(s)与H2(g)、O2(g)反应生成CH3COOH(l)在该条件下的热化学方程式为
(4)由N2和H2合成1molNH3时可放出46.2kJ的热量.从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是
(1)工业接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g)?2SO3(g)△H=-190kJ?mol-1该热化学反应方程式的意义是
在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ,
在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ,
.(2)在25℃、101kPa下,1g甲醇[CH3OH(l)]燃烧生成CO2和液态水时放热.22.68kJ.则表示甲醇燃烧热的热化学方程式为
CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ?mol-1
| 3 |
| 2 |
CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ?mol-1
.| 3 |
| 2 |
(3)已知25℃、l01kPa时下列反应的热化学方程式为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
③H2(g)+
| 1 |
| 2 |
2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol
2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol
.(4)由N2和H2合成1molNH3时可放出46.2kJ的热量.从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是
391.6kJ/mol
391.6kJ/mol
.分析:(1)根据热化学方程式应注明反应热的测定条件、聚集状态、反应热的数值、单位、符号,其化学计量数表示该物质的物质的量;
(2)根据燃烧热是1mol可燃物完全燃烧生成温度氧化物时放出的热量以及热化学方程式中物质的量与能量成正比;
(3)根据盖斯定律构造出目标反应热化学反应方程式;
(4)根据断裂旧键要吸热,形成新键要放热,反应热等于反应物的总键能减去生成物的总键能计算;
(2)根据燃烧热是1mol可燃物完全燃烧生成温度氧化物时放出的热量以及热化学方程式中物质的量与能量成正比;
(3)根据盖斯定律构造出目标反应热化学反应方程式;
(4)根据断裂旧键要吸热,形成新键要放热,反应热等于反应物的总键能减去生成物的总键能计算;
解答:(1)该热化学方程式的意义是:在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ,
故答案为:在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ;
(2)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ,则表示燃烧热的热化学方程式为:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ?mol-1,
故答案为:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-725.8 kJ?mol-1;
(3)①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
③H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol,
根据盖斯定律,②×2+③×2-①得:2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol;
故答案为:2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol;
(4)N2和H2合成NH3的方程式为:N2+3H2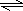 2NH3,由N2和H2合成1molNH3时可放出46.2kJ的热量,则生成2mol放出的热量为2×46.2kJ=92.4kJ,
2NH3,由N2和H2合成1molNH3时可放出46.2kJ的热量,则生成2mol放出的热量为2×46.2kJ=92.4kJ,
1molN2和3molH2反应断裂化学键需要吸收的能量为:1mol×948.9kJ?mol-1+3×436.0kJ?mol-1=2256.9kJ,
N-H键的键能为x,形成2molNH3需要形成6molN-H键,则形成6molN-H键放出的能量为6x,
则6mol×x-2256.9kJ=92.4kJ,解得x=391.6kJ/mol,
故答案为:391.6kJ/mol;
故答案为:在450℃时,2molSO2气体和1molO2气体完全反应生成2molSO3气体时放出的热量为190kJ;
(2)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热725.8KJ,则表示燃烧热的热化学方程式为:CH3OH(l)+
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(3)①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJ/mol
②C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
③H2(g)+
| 1 |
| 2 |
根据盖斯定律,②×2+③×2-①得:2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol;
故答案为:2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=-488.3kJ/mol;
(4)N2和H2合成NH3的方程式为:N2+3H2
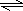 2NH3,由N2和H2合成1molNH3时可放出46.2kJ的热量,则生成2mol放出的热量为2×46.2kJ=92.4kJ,
2NH3,由N2和H2合成1molNH3时可放出46.2kJ的热量,则生成2mol放出的热量为2×46.2kJ=92.4kJ,1molN2和3molH2反应断裂化学键需要吸收的能量为:1mol×948.9kJ?mol-1+3×436.0kJ?mol-1=2256.9kJ,
N-H键的键能为x,形成2molNH3需要形成6molN-H键,则形成6molN-H键放出的能量为6x,
则6mol×x-2256.9kJ=92.4kJ,解得x=391.6kJ/mol,
故答案为:391.6kJ/mol;
点评:本题考查热化学方程式的意义、书写、反应热的概念、计算以及盖斯定律的运用,题目难度不大,注意盖斯定律的理解与应用.

练习册系列答案
相关题目
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
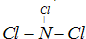
 O2(g)=H2O(l)△H=-285.8kJ/mol,则C(s)与H2(g)、O2(g)反应生成CH3COOH(l)在该条件下的热化学方程式为______.
O2(g)=H2O(l)△H=-285.8kJ/mol,则C(s)与H2(g)、O2(g)反应生成CH3COOH(l)在该条件下的热化学方程式为______.