摘要:4.常温下.用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图所示.下列说法正确的是( ) A.点①所示溶液中: c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) B.点②所示溶液中: c(Na+)=c(CH3COOH)+c(CH3COO-) C.点③所示溶液中: c(Na+)>c(OH-)>c(CH3COO-)>c(H+) D.滴定过程中可能出现: c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) 解析:本题考查溶液中的电荷守恒.物料守恒和质子守恒等关系.意在考查考生灵活运用上述三个守恒关系的能力.A项.根据电荷守恒关系有:c(CH3COO-)+c(OH-)=c(Na+)+c(H+).此时溶液中的c(CH3COOH)与c(Na+)不相等.故不正确,B项.点②溶液呈中性.所加入的氢氧化钠溶液的体积小于20 mL.此时根据物料守恒可知c(Na+)<c(CH3COO-)+c(CH3COOH).故不正确,C项.点③溶液中两者恰好完全反应.溶液中各离子浓度关系应为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+).故不正确,D项.当刚加入少量氢氧化钠溶液时可能会出现题中情况.故正确. 答案:D
网址:http://m.1010jiajiao.com/timu3_id_84812[举报]
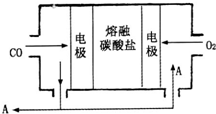 (2013?德州模拟)钠及其化合物具有广泛的用途.
(2013?德州模拟)钠及其化合物具有广泛的用途.(1)工业上可利用反应Na(l)+KCl(l)?K(g)+NaCl(l)来治炼金属钾,此反应利用了钠的还原性及
金属钠的沸点高于金属钾的沸点
金属钠的沸点高于金属钾的沸点
,写出钠与TiCl4反应冶炼Ti的化学方程式4Na+TiCl4
Ti+4NaCl
| ||
4Na+TiCl4
Ti+4NaCl
.
| ||
(2)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如右:负极电极反应式为
2CO-4e-+2CO32-=4CO2
2CO-4e-+2CO32-=4CO2
,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2
CO2
.(3)常温下,浓度均为0.1mol?L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
CO32-
CO32-
,根据表中数据,浓度均为0.01mol?L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C
C
(填编号).A.HCN B.HClO C.CH3COOH D.H2CO3
(4)实验室中常用NaOH来进行洗气和提纯.当300mL 1mol?L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为
C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+)
C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+)
.(5)几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
Cu2+
Cu2+
(填离子符号)先沉淀,KSP[(Fe(OH)2]<
<
KSP[(Mg(OH)2](填“>”、“=”或“<”).(2012?唐山三模)(1)常温下,浓度均为0.1mol/L的6种溶液的pH如下表:
①上述溶液中的阴离子结合H+能力最弱的为
②结合表中数据分析,与0.1mol/L的CH3OONa溶液中水的电离程度相同的是(填字母代号)
A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.1mol/L的NaCN溶液
E.pH=8.8的Na2CO3溶液
F.0.1mol/L的CH3COONH4溶液
③将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度由大到小的顺序为
④100℃时纯水中c(H+)=10-6mol/L,在此温度下某浓度的e溶液的pH=n,则c(H+)+c(HCN)
(2)已知2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25KJ/mol,则该反应的化学平衡常数K的表达式为
若某温度下K=400,在1L密闭容器中加入CH3OH,反应到t时刻,各组分浓度如下:
①判断下列说法正确的是
A.增大压强,可以提高CH3OH的转化率
B.平衡时再向容器中加入CH3OCH3和水蒸气各1mol,平衡不移动
C.平衡后升高温度,K>400
D.平衡时再加入与起始等量的CH3OH,达新平衡后,CH3OH转化率不变
②达平衡时体系总能量减少
查看习题详情和答案>>
| 序号 | a | b | c | d | e | f |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5Na |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
CH3COO-
CH3COO-
,d溶液呈碱性的原因是ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
(用离子方程式表示).②结合表中数据分析,与0.1mol/L的CH3OONa溶液中水的电离程度相同的是(填字母代号)
BE
BE
.A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.1mol/L的NaCN溶液
E.pH=8.8的Na2CO3溶液
F.0.1mol/L的CH3COONH4溶液
③将浓度均为0.1mol/L的b、c等体积混合,所得溶液中各离子浓度由大到小的顺序为
c(Cl-)>c(H+)>c(NH4+)>c(OH-)
c(Cl-)>c(H+)>c(NH4+)>c(OH-)
.④100℃时纯水中c(H+)=10-6mol/L,在此温度下某浓度的e溶液的pH=n,则c(H+)+c(HCN)
10n-12
10n-12
mol/L.(2)已知2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-25KJ/mol,则该反应的化学平衡常数K的表达式为
K=
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
K=
.| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
若某温度下K=400,在1L密闭容器中加入CH3OH,反应到t时刻,各组分浓度如下:
| 物质 | CH3OH | CHO3CH3 | H2O |
| 浓度/mol/L | 0.8 | 1.24 | 1.24 |
D
D
(填字母代号).A.增大压强,可以提高CH3OH的转化率
B.平衡时再向容器中加入CH3OCH3和水蒸气各1mol,平衡不移动
C.平衡后升高温度,K>400
D.平衡时再加入与起始等量的CH3OH,达新平衡后,CH3OH转化率不变
②达平衡时体系总能量减少
31
31
kJ.常温下,用0.01 mol·L-1 H2SO4滴定0.01 mol·L-1 NaOH溶液,中和后加水至100 mL。若滴定时终点判断有误差:①多加了1滴H2SO4;②少加了1滴H2SO4(设1滴为0.05 mL)。则①和②c(H+)之比是( )
A.10 B.50
C.5×103 D.104
查看习题详情和答案>>(14分)用一定物质的量浓度的NaOH溶液滴定10.00 mL已知浓度的盐酸,滴定结果如图所示。回答下列问题:
(1)有关滴定的操作可分解为如下几步,并补充完整。①用NaOH溶液润洗滴定管。②取NaOH溶液注入碱式滴定管至“0”刻度以上2~3 mL。③ ④调节液面至“0”或“0”刻度以下,记下读数。⑤移取10.00 mL盐酸注入锥形瓶中,加入酚酞。⑥把锥形瓶放在滴定管的下面,用氢氧化钠溶液滴定并记下读数。
(2)若滴定前俯视滴定管读数,滴定后平视刻度读数,则会使氢氧化钠浓度的测定结果 (填“偏高”“偏低”或“不变”)。
(3)如用酚酞作指示剂,则滴定终点的实验现象是 。
(4)c(HCl)= mol·L-1
(5)c(NaOH) = mol·L-1
(6)右图表示50 mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号) 。
| A.是a mL | B.是(50-a)mL |
| C.一定大于a mL | D.一定大于(50-a)mL |