题目内容
 (2013?德州模拟)钠及其化合物具有广泛的用途.
(2013?德州模拟)钠及其化合物具有广泛的用途.(1)工业上可利用反应Na(l)+KCl(l)?K(g)+NaCl(l)来治炼金属钾,此反应利用了钠的还原性及
金属钠的沸点高于金属钾的沸点
金属钠的沸点高于金属钾的沸点
,写出钠与TiCl4反应冶炼Ti的化学方程式4Na+TiCl4
Ti+4NaCl
| ||
4Na+TiCl4
Ti+4NaCl
.
| ||
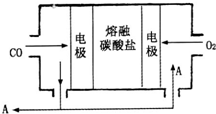
(2)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如右:负极电极反应式为
2CO-4e-+2CO32-=4CO2
2CO-4e-+2CO32-=4CO2
,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2
CO2
.(3)常温下,浓度均为0.1mol?L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
CO32-
CO32-
,根据表中数据,浓度均为0.01mol?L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C
C
(填编号).A.HCN B.HClO C.CH3COOH D.H2CO3
(4)实验室中常用NaOH来进行洗气和提纯.当300mL 1mol?L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为
C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+)
C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+)
.(5)几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
Cu2+
Cu2+
(填离子符号)先沉淀,KSP[(Fe(OH)2]<
<
KSP[(Mg(OH)2](填“>”、“=”或“<”).分析:(1)根据平衡移动原理,为使反应向正反应方向进行,可使生成物从平衡体系中分离出来,由Na和K的沸点大小,制取的适宜温度应能使K蒸汽分离出,而钠为液体;
根据题中信息书以及原子守恒写化学方程式;
(2)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;将两个方程式相加即得一氧化碳燃烧方程式;根据电极反应分析即可;
(3)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大;
(4)先分析溶液中的成分,再根据盐类的水解和电荷守恒来分析,注意盐类的水解是微弱的;
(5)结合金属离子开始沉淀的pH来分析;根据同类型的沉淀,金属离子开始沉淀的pH来计算出KSP,金属离子的浓度相同,C(OH-)越大,KSP越大;
根据题中信息书以及原子守恒写化学方程式;
(2)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;将两个方程式相加即得一氧化碳燃烧方程式;根据电极反应分析即可;
(3)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大;
(4)先分析溶液中的成分,再根据盐类的水解和电荷守恒来分析,注意盐类的水解是微弱的;
(5)结合金属离子开始沉淀的pH来分析;根据同类型的沉淀,金属离子开始沉淀的pH来计算出KSP,金属离子的浓度相同,C(OH-)越大,KSP越大;
解答:解:(1)制取的适宜温度应能使K蒸汽分离出,而钠为液体,即金属钠的沸点高于金属钾的沸点;钠与TiCl4反应冶炼Ti,同时得到氯化钠,方程式为:4Na+TiCl4
Ti+4NaCl,故答案为:金属钠的沸点高于金属钾的沸点;4Na+TiCl4
Ti+4NaCl;
(2)该燃料电池的总反应为:2CO+O2=2CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为:2CO-4e-+2CO32-=4CO2,由电极反应可知电池工作时参加循环的物质为CO2,
故答案为:2CO-4e-+2CO32-=4CO2;CO2;
(3)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,所以最易水解的盐是碳酸钠,所以最容易结合氢离子的阴离子是CO32-;浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大,HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,所以溶液的pH变化最大的是醋酸,故答案为:CO32-;C;
(4)300mL 1mol?L-1的NaOH的物质的量=1mol/L×0.4L=0.3mol,标准状况下4.48LCO2的物质的量=
=0.2mol,这样,反应后的溶液就是0.1mol的NaHCO3和0.1mol的Na2CO3,无论碳酸钠还是碳酸氢钠,溶液都呈碱性,即:C(OH-)>C(H+),溶液中氢氧根离子有两个来源,一个是碳酸根离子水解,一个是碳酸氢根离子水解,碳酸根离子水解程度大于碳酸氢根离子的水解,所以C(HCO3-)>C(CO32-)>C(OH-),故溶液中各离子浓度大小顺序是
C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+),故答案为:C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+);
(5)Cu2+开始沉淀的pH最小,所以Cu2+先沉淀;Mg2+、Fe2+开始沉淀的C(OH-)分别为:10-3.6mol?L-1、10-6.4mol?L-1,所以KSP[(Fe(OH)2]<KSP[(Mg(OH)2],故答案为:Cu2+;<.
| ||
| ||
(2)该燃料电池的总反应为:2CO+O2=2CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为:2CO-4e-+2CO32-=4CO2,由电极反应可知电池工作时参加循环的物质为CO2,
故答案为:2CO-4e-+2CO32-=4CO2;CO2;
(3)越容易水解的盐,越容易结合氢离子,相同浓度的钠盐溶液,pH越大则盐的水解程度越大,所以最易水解的盐是碳酸钠,所以最容易结合氢离子的阴离子是CO32-;浓度相同的酸稀释相同的倍数后,酸性越强的酸其pH变化越大,HCN、HClO、CH3COOH、H2CO3四种酸的酸性大小顺序是CH3COOH>H2CO3>HClO>HCN,所以溶液的pH变化最大的是醋酸,故答案为:CO32-;C;
(4)300mL 1mol?L-1的NaOH的物质的量=1mol/L×0.4L=0.3mol,标准状况下4.48LCO2的物质的量=
| 4.48L |
| 22.4L/mol |
C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+),故答案为:C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+);
(5)Cu2+开始沉淀的pH最小,所以Cu2+先沉淀;Mg2+、Fe2+开始沉淀的C(OH-)分别为:10-3.6mol?L-1、10-6.4mol?L-1,所以KSP[(Fe(OH)2]<KSP[(Mg(OH)2],故答案为:Cu2+;<.
点评:本题考查了平衡移动原理、电极反应方程式的书写、离子浓度大小的比较、溶液pH的计算等知识点,离子浓度大小的比较是学习的难点,一般利用电荷守恒、物料守恒和质子守恒来分析解答.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目



 (2013?德州模拟)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol?L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示.则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )
(2013?德州模拟)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol?L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示.则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )

