题目内容
 铁、铝是现代金属材料的主角.
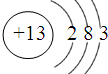
铁、铝是现代金属材料的主角.(1)写出Al的原子结构示意图

3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O
3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O
;(2)已知:铝的燃烧热为1675kJ?mol-1;2Fe(s)+3/2O2(g)═Fe2O3(s);△H=-822kJ?mol-1;则2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s);△H=
-2528KJ/mol
-2528KJ/mol
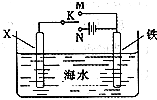
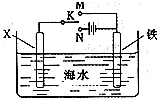
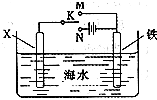
;(3)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于
N
N
处(填“M”或“N”).若X为锌,开关K置于M处,则此时铁棒上发生的电极反应方程式为O2+4e-+2H2O═4OH-
O2+4e-+2H2O═4OH-
;(4)对金属制品进行抗腐蚀处理,可延长其使用寿命.铁制品表面镀铜可防止其腐蚀,电镀时为了补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定,则阳极材料必须为
Cu
Cu
.分析:(1)根据原子核外电子的排布规律来回答,根据稀硝酸的氧化性和金属铁的还原性来分析反应过程;
(2)根据盖斯定律来计算反应的焓变;
(3)根据金属的电化学防护原理和应用来分析;
(4)根据电镀的原理和电镀装置的特点来回答.
(2)根据盖斯定律来计算反应的焓变;
(3)根据金属的电化学防护原理和应用来分析;
(4)根据电镀的原理和电镀装置的特点来回答.
解答:解:(1)根据原子核外电子排布的规律知13号铝原子结构示意图为: ,铁能被硝酸氧化为最高价,而过量的铁和三价铁又归中到亚铁离子,故稀硝酸溶液中加入过量铁粉发生反应的离子反应方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4 H2O,故答案为:
,铁能被硝酸氧化为最高价,而过量的铁和三价铁又归中到亚铁离子,故稀硝酸溶液中加入过量铁粉发生反应的离子反应方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4 H2O,故答案为: ;3Fe+8H++2NO3-═3Fe2++2NO↑+4 H2O;
;3Fe+8H++2NO3-═3Fe2++2NO↑+4 H2O;
(2)结合铝的燃烧热含义,可得4Al(s)+3O2(g)═2Al2O3(S)△H=-4×1675kJ?mol-1=-6700kJ?mol-1,根据盖斯定律,反应2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)的△H=-0.5×1675kJ?mol-1+822kJ?mol-1=-2528KJ/mol,故答案为:-2528KJ/mol;
(3)在电解池中金属作为阴极可以起到保护作用,故为减缓铁的腐蚀,开关K应该置于N处,若X为锌,开关K置于M处,则此时为原电池装置,铁棒为正极,锌为负极,锌发生吸氧腐蚀,铁电极反应方程式为:O2+4e-+2H2O═4OH-,故答案为:N;O2+4e-+2H2O═4OH-;
(4)根据电镀的原理和电镀装置的特点,阳极必须为镀层金属,故答案为:Cu.
 ,铁能被硝酸氧化为最高价,而过量的铁和三价铁又归中到亚铁离子,故稀硝酸溶液中加入过量铁粉发生反应的离子反应方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4 H2O,故答案为:
,铁能被硝酸氧化为最高价,而过量的铁和三价铁又归中到亚铁离子,故稀硝酸溶液中加入过量铁粉发生反应的离子反应方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4 H2O,故答案为: ;3Fe+8H++2NO3-═3Fe2++2NO↑+4 H2O;
;3Fe+8H++2NO3-═3Fe2++2NO↑+4 H2O;(2)结合铝的燃烧热含义,可得4Al(s)+3O2(g)═2Al2O3(S)△H=-4×1675kJ?mol-1=-6700kJ?mol-1,根据盖斯定律,反应2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)的△H=-0.5×1675kJ?mol-1+822kJ?mol-1=-2528KJ/mol,故答案为:-2528KJ/mol;
(3)在电解池中金属作为阴极可以起到保护作用,故为减缓铁的腐蚀,开关K应该置于N处,若X为锌,开关K置于M处,则此时为原电池装置,铁棒为正极,锌为负极,锌发生吸氧腐蚀,铁电极反应方程式为:O2+4e-+2H2O═4OH-,故答案为:N;O2+4e-+2H2O═4OH-;
(4)根据电镀的原理和电镀装置的特点,阳极必须为镀层金属,故答案为:Cu.
点评:本题考查学生有关金属铁的性质、原子结构以及电化学和热化学知识,要求学生具备分析和解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 Fe2O3(s);ΔH=-822 kJ·mol-1;
Fe2O3(s);ΔH=-822 kJ·mol-1; Al2O3(s)+2Fe(s);ΔH=________;
Al2O3(s)+2Fe(s);ΔH=________;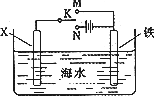

 铁、铝是现代金属材料的主角.
铁、铝是现代金属材料的主角.