摘要:3.短周期元素X.Y.Z在周期表中的位置如图所示.下列说法正确的是( ) A.X的非金属性最强 B.X单质的熔点比Z低 C.Z的氢化物的稳定性比Y强 D.Y的最高正化合价为+7 解析:根据三种元素的相对位置推断X为He.Y为F.Z为S.三种元素中F的非金属性最强.A错误,氦气的熔点比硫的低.B正确,HF的稳定性强于H2S.C错误,F元素没有正化合价.D错误. 答案:B
网址:http://m.1010jiajiao.com/timu3_id_84742[举报]
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
| X | ||
| Y | ||
| Z |
| A、Z 是活泼的金属元素 |
| B、Y的最高价氧化物的水化物是一种强酸 |
| C、1mol铁跟足量的Z单质化合时,转移的电子为2mol |
| D、Z的氢化物稳定性大于Y的氢化物 |
I.短周期元素X、Y、Z在元素周期表中的位置如图所示,其中Y元素原子的最外层电子数是电子层数的两倍.
回答下列问题:
(1)Y元素在元素周期表中的位置是 .
(2)列举一个事实证明Y元素与Z元素的非金属性强弱: .
(3)X的气态氢化物与其最高价氧化物对应的水化物反应生成盐.该盐溶液的pH 7(填“<”、“>”或“=”),其原因为(用离子方程式表示) .
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键.该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体.该反应的化学方程式为 .
II.已知可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),平衡常数见下表:
(5)该反应△H 0(填“<”或“>”).
(6)850℃时,若向一容积固定的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2,若要使上述反应开始时正向进行,则x应满足的条件
是 .若x=5.0,当反应达到平衡时,n(H2)= .
查看习题详情和答案>>
回答下列问题:
| X | ||
| Y | Z |
(2)列举一个事实证明Y元素与Z元素的非金属性强弱:
(3)X的气态氢化物与其最高价氧化物对应的水化物反应生成盐.该盐溶液的pH
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键.该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体.该反应的化学方程式为
II.已知可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),平衡常数见下表:
| 温度/℃ | 500 | 700 | 850 | 1 000 |
| 平衡常数 | 2.5 | 1.7 | 1.0 | 0.6 |
(6)850℃时,若向一容积固定的密闭容器中同时充入1.0mol CO、3.0mol H2O、1.0mol CO2和x mol H2,若要使上述反应开始时正向进行,则x应满足的条件
是
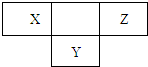 短周期元素X、Y、Z在周期表中所处的位置如图所示,三种元素的原子质子数之和为32,下列说法正确的是( )
短周期元素X、Y、Z在周期表中所处的位置如图所示,三种元素的原子质子数之和为32,下列说法正确的是( )| A、三种元素中,Z元素的最高价氧化物对应的水化物的酸性最强 | B、X、Z两种元素的气态氢化物相互反应的产物是共价化合物 | C、三种元素对应的气态氢化物中,Z元素形成的氢化物最稳定 | D、Y元素的气态氢化物与Y的最高价氧化物对应的水化物不可能发生反应 |
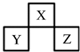 短周期元素X、Y、Z在元素周期表中的位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z在元素周期表中的位置如图所示.下列说法正确的是( )| A、原子半径的大小为:Z>Y>X | B、若Y的氧化物为两性氧化物,则X、Z分别形成单质的微观结构中均可能具有正四面体构型 | C、若X的氢化物与Z的最高价氧化物对应水化物能反应,则生成的盐仅有一种 | D、若Y与Z的核电荷数之和为X的4倍,则X、Z形成的对应氢化物的熔沸点前者高于后者 |