摘要:17.六种元素A.B.C.D.E.F的原子序数依次增大.且A.B.C.D.E.F均为短周期元素.B与A能以1∶1.1∶2或1∶3等形成多种常见化合物,C与D相邻.D与F元素位于同一主族,D与E能以1∶1或1∶2形成两种常见化合物. (1)A与B能形成一种最简单的直线型分子.其结构式是 . (2)A.D.F元素中形成的两种双核阴离子.在溶液中反应的离子方程式为 . (3)E与F形成的化合物的电子式为 .该化合物的水溶液显碱性.原因是 .用惰性电极电解该化合物的水溶液时.有固体析出.反应化学方程式为 . 解析:依题意可以推知:A.B.C.D.E.F所代表的元素分别是H.C.N.O. Na.S. 答案:HS-+OH-―→S2-+H2O (3)Na+[ ]2-Na+ S2-+H2OHS-+OH- Na2S+2H2O电解2NaOH+H2↑+S↓
网址:http://m.1010jiajiao.com/timu3_id_84464[举报]
六种元素A、B、C、D、E、F的原子序数依次增大,且A、B、C、D、E、F均为短周期元素,B与A能以1∶1、1∶2或1∶3等形成多种常见化合物;C与D相邻,D与F元素位于同一主族;D与E能以1∶1或1∶2形成两种常见化合物.
(1)A与B能形成一种最简单的直线型分子,其结构式是____________________.
(2)A、D、F元素中形成的两种双核阴离子,在溶液中反应的离子方程式为________________________.
(3)E与F形成的化合物的电子式为________________________,该化合物的水溶液显碱性,原因是(用离子方程式表示)______________________________,用惰性电极电解该化合物的水溶液时,有固体析出,反应化学方程式为______________________________________.
查看习题详情和答案>>
(1)A与B能形成一种最简单的直线型分子,其结构式是____________________.
(2)A、D、F元素中形成的两种双核阴离子,在溶液中反应的离子方程式为________________________.
(3)E与F形成的化合物的电子式为________________________,该化合物的水溶液显碱性,原因是(用离子方程式表示)______________________________,用惰性电极电解该化合物的水溶液时,有固体析出,反应化学方程式为______________________________________.
现有六种元素A、B、C、D、E、F均为周期表中前20号元素,且原子序数依次增大.已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物.D元素的原子半径是短周期主族元素中最大的;E元素在地壳中含量居第二位;F是组成人体骨骼的牙齿的主要元素.
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料.通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
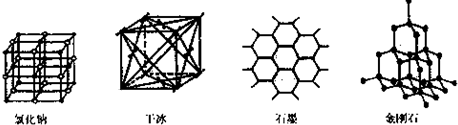
(5)如图是中学常见的几种晶体结构.有关说法正确的是 (填选项).
A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的.
查看习题详情和答案>>

请回答以下问题:
(1)请画出F的离子结构示意图:
(2)工业上制取E单质的化学方程式为:
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料.通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式:
(5)如图是中学常见的几种晶体结构.有关说法正确的是
A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的.
现有六种元素A、B、C、D、E、F均为周期表中前20号元素,且原子序数依次增大。已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物。D元素的原子半径是短周期主族元素中最大的;E元素在地壳中含量居第二位;F是组成人体骨骼的牙齿的主要元素。
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
(5)下图是中学常见的几种晶体结构。有关说法正确的是 (填选项)。

A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的
查看习题详情和答案>>(18分)现有六种元素A、B、C、D、E、F均为周期表中前20号元素,且原子序数依次增大。已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物。D元素的原子半径是短周期主族元素中最大的;E元素在地壳中含量居第二位;F是组成人体骨骼的牙齿的主要元素。
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
(5)下图是中学常见的几种晶体结构。有关说法正确的是 (填选项)。
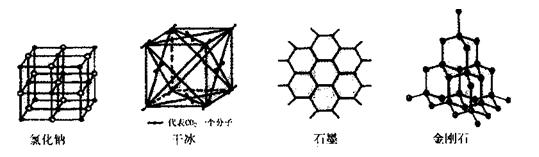
A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
(5)下图是中学常见的几种晶体结构。有关说法正确的是 (填选项)。

A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的
A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族.A、C能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1.B元素基态原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素.根据以上信息回答下列问题:
(1)D元素的名称为
(2)C、D、F的简单离子中,半径最小的是
(3)BA4的空间构型为
(4)由这六种元素形成的单质和化合物中,可以相互反应生成H2的化学方程式为
(5)下列关于甲和乙的说法中,错误的是
①乙分子中含有非极性键,一定是非极性分子
②甲的沸点较高与分子间形成氢键有关
③甲中中心原子采取sp2杂化
④乙在一定条件下可以分解生成甲
⑤甲分子中极性键的极性向量和为零.
查看习题详情和答案>>
(1)D元素的名称为
氟
氟
,E的电子排布式为ls22s22p63s1
ls22s22p63s1
;(2)C、D、F的简单离子中,半径最小的是
Al3+
Al3+
(填离子符号);(3)BA4的空间构型为
正四面体
正四面体
,B、C两元素形成的非极性分子的结构式为O=C=O
O=C=O
;(4)由这六种元素形成的单质和化合物中,可以相互反应生成H2的化学方程式为
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
,可以相互反应生成O2的化学方程式为2Na2O2+CO2═2Na2CO3+O2
2Na2O2+CO2═2Na2CO3+O2
;(5)下列关于甲和乙的说法中,错误的是
①③⑤
①③⑤
(填序号)①乙分子中含有非极性键,一定是非极性分子
②甲的沸点较高与分子间形成氢键有关
③甲中中心原子采取sp2杂化
④乙在一定条件下可以分解生成甲
⑤甲分子中极性键的极性向量和为零.