网址:http://m.1010jiajiao.com/timu3_id_84231[举报]
(一) 欲配制500mL0.2mol/LNa2CO3溶液,回答下列问题:
(1)应称取 g Na2CO3·10H2O。
(2)配制该溶液所用的仪器有 ____ 。
(3)下列操作使所配溶液浓度偏低的是( )
A、容量瓶未干燥即用来配制溶液 B、往容量瓶转移溶液时有少量液体溅出
C、未洗涤溶解固体的烧杯 D、定容时,仰视刻度线
(二)某化学小组在实验室用下图提供的仪器制备溴乙烷。

已知:
①反应原理:NaBr+H2SO4(较浓)△=== NaHSO4+HBr
HBr+C2H5OHC2H5Br+H2O
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO4 30mL,水15mL
③溴乙烷和乙醇的部分物理性质如下表
| 密度/g·mL-1 | 沸点/℃ | 溶解性 | |
| 溴乙烷 | 1.461 | 38 | 难溶于水 |
| 乙醇 | 0.789 | 78 | 易溶于水 |
回答下列问题:
(4)连接上述仪器的顺序是:1接( )接( )接( 4 )接( 3 )接( )(填数字)。你认为反应后溴乙烷在 (填“烧瓶”或“烧杯”)中
(5)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是 (写化学式),除去该杂质的试剂和方法是 ,为了减少该副产物的生成,根据加入的反应物,本实验采取了 _________________________________________________________的措施。
查看习题详情和答案>>(一) 欲配制500mL0.2mol/LNa2CO3溶液,回答下列问题:
(1)应称取 g Na2CO3·10H2O。
(2)配制该溶液所用的仪器有 ____ 。
(3)下列操作使所配溶液浓度偏低的是( )
A、容量瓶未干燥即用来配制溶液 B、往容量瓶转移溶液时有少量液体溅出
C、未洗涤溶解固体的烧杯 D、定容时,仰视刻度线
(二)某化学小组在实验室用下图提供的仪器制备溴乙烷。
已知:
①反应原理:NaBr+H2SO4(较浓)△=== NaHSO4+HBr
HBr+C2H5OHC2H5Br+H2O
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO4 30mL,水15mL
③溴乙烷和乙醇的部分物理性质如下表
|
| 密度/g·mL-1 | 沸点/℃ | 溶解性 |
| 溴乙烷 | 1.461 | 38 | 难溶于水 |
| 乙醇 | 0.789 | 78 | 易溶于水 |
回答下列问题:
(4)连接上述仪器的顺序是:1接( )接( )接(4 )接( 3 )接( )(填数字)。你认为反应后溴乙烷在 (填“烧瓶”或“烧杯”)中
(5)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是 (写化学式),除去该杂质的试剂和方法是 ,为了减少该副产物的生成,根据加入的反应物,本实验采取了 _________________________________________________________的措施。
查看习题详情和答案>>
(一) 欲配制500mL0.2mol/LNa2CO3溶液,回答下列问题:
(1)应称取 g Na2CO3·10H2O。
(2)配制该溶液所用的仪器有 ____ 。
(3)下列操作使所配溶液浓度偏低的是( )
A、容量瓶未干燥即用来配制溶液 B、往容量瓶转移溶液时有少量液体溅出
C、未洗涤溶解固体的烧杯 D、定容时,仰视刻度线
(二)某化学小组在实验室用下图提供的仪器制备溴乙烷。
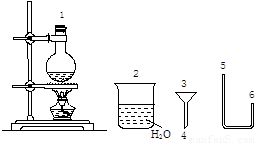
已知:
①反应原理:NaBr+H2SO4(较浓)△=== NaHSO4+HBr
HBr+C2H5OHC2H5Br+H2O
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO4 30mL,水15mL
③溴乙烷和乙醇的部分物理性质如下表
|
|
密度/g·mL-1 |
沸点/℃ |
溶解性 |
|
溴乙烷 |
1.461 |
38 |
难溶于水 |
|
乙醇 |
0.789 |
78 |
易溶于水 |
回答下列问题:
(4)连接上述仪器的顺序是:1接( )接( )接( 4 )接( 3 )接( )(填数字)。你认为反应后溴乙烷在 (填“烧瓶”或“烧杯”)中
(5)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是 (写化学式),除去该杂质的试剂和方法是 ,为了减少该副产物的生成,根据加入的反应物,本实验采取了 _________________________________________________________的措施。
查看习题详情和答案>>
(p)应称取______g Na2CO3?p0H2O.
(2)配制该溶液所用的仪器有______.
(3)下列操作使所配溶液浓度偏低的是______
A、容量瓶未干燥即用来配制溶液 B、往容量瓶转移溶液时有少量液体溅出
C、未洗涤溶解固体的烧杯 D、定容时,仰视刻度线
(二)某化学小组在实验室用下图提供的仪器制备溴乙烷.
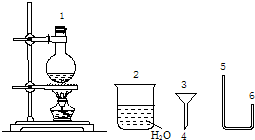
已知:
①反应原理:NaB9+H2SO4(较浓)
| ||
HB9+C2H5OH
| △ |
②反应物用量:NaB9(S)25g,无水乙醇p5ml,浓H2SO430ml,水p5ml
③溴乙烷和乙醇的部分物理性质如表
| 密度/g?ml-p | 沸点/℃ | 溶解性 | |
| 溴乙烷 | p.46p | 38 | 难溶于水 |
| 乙醇 | 0.789 | 78 | 易溶于水 |
(4)连接上述仪器的顺序是:p接______接______接( 4 )接( 3 )接______(填数字).你认为反应后溴乙烷在______(填“烧瓶”或“烧杯”)中
(5)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是______(写化学式),除去该杂质的试剂和方法是______,为了减少该副产物的生成,本实验采取了______的措施.
(1)应称取______gNa2CO3?10H2O.
(2)配制该溶液所用的仪器有______.
(3)下列操作使所配溶液浓度偏低的是______
A、容量瓶未干燥即用来配制溶液B、往容量瓶转移溶液时有少量液体溅出
C、未洗涤溶解固体的烧杯D、定容时,仰视刻度线
(二)某化学小组在实验室用下图提供的仪器制备溴乙烷.

已知:
①反应原理:NaBr+H2SO4(较浓)
| ||
HBr+C2H5OH
| △ |
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO430mL,水15mL
③溴乙烷和乙醇的部分物理性质如表
| 密度/g?mL-1 | 沸点/℃ | 溶解性 | |
| 溴乙烷 | 1.461 | 38 | 难溶于水 |
| 乙醇 | 0.789 | 78 | 易溶于水 |
(4)连接上述仪器的顺序是:1接______接______接(4)接(3)接______(填数字).你认为反应后溴乙烷在______(填“烧瓶”或“烧杯”)中
(5)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是______(写化学式),除去该杂质的试剂和方法是______,为了减少该副产物的生成,本实验采取了______的措施.